
【题目】用下列实验装置进行相应的实验,不能达到实验目的是( )
A | B | C | D | |
装置 |
|
|
|
|
实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性Cl>C>Si |
A.A
B.B
C.C
D.D
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3﹣可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4﹣ . 通电电解,然后通入H2S加以处理,下列说法不正确的是( ) 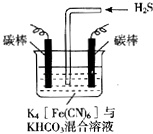
A.电解时阳极反应式为[Fe(CN)6]4﹣﹣e﹣=[Fe(CN)6]3﹣
B.电解过程中阴极区溶液的pH变大
C.整个过程中需要不断补充K4[Fe(CN)6]与KHCO3
D.通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3﹣+2CO32﹣+H2S=2[Fe(CN)6]4﹣+2HCO3﹣+S↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①CaCO3(s)═CaO+CO2(g)△H=+177.7kJ
②C(s)+H2O(s)═CO(g)+H2(g)△H=﹣131.3kJmol﹣1
③ ![]() H2SO4(1)+NaOH(1)═
H2SO4(1)+NaOH(1)═ ![]() Na2SO4(1)+H2O(1)△H=﹣57.3kJmol﹣1
Na2SO4(1)+H2O(1)△H=﹣57.3kJmol﹣1
④C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
⑤CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283kJmol﹣1
O2(g)═CO2(g)△H=﹣283kJmol﹣1
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(1)△H=﹣57.3kJmol﹣1
⑦2H2(g)+O2(g)═2H2O(1)△H=﹣517.6kJmol﹣1
(1)上述热化学方程式中,不正确的有 , 不正确的理由分别是 .
(2)根据上述信息,写出C转化为CO的热化学方程式: .
(3)上述反应中,表示燃烧热的热化学方程式有;表示中和热的热化学方程式有
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组向某2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)D(g)+E(g)△H=QkJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的物质的量如下表:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T1℃时,该反应的平衡常数K=;
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是(填字母编号).
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2molB、0.1molD,0.1molE
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为如图中的(填序号) 
(4)维持容器的体积和温度T1不变,当向该容器中加入1.60molB,0.20molD,0.20molE和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n取值范围mol.
(5)维持容器的体积和温度T1不变,各物质的起始物质的量为:n(A)=1.0mol,n(B)=3.0mol,n(D)=amol,n(E)=0mol,达到平衡后,n(E)=0.50mol,则a= .
(6)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图所示由图可知,Q0(填“大于”或“小于”),c点v正v逆(填“大于”、“小于”或“等于”.) 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别滴加相同浓度盐酸30.0mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如表.
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2的体积(mL) | 672 | 840 | 896 | 672 |
(1)样品中物质的量之比n(Na2CO3):n(NaHCO3)=;
(2)盐酸的物质的量浓度c(HCl)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液X中,可能含有Na+、Cu2+、Mg2+、Al3+、SiO32﹣、AlO2﹣、CO32﹣、Cl﹣中的一种或几种.现取该溶液适量,向其中加入一定物质的量浓度的稀盐酸,产生沉淀的物质的量(n)与加入盐酸的体积(V)的关系如图所示,下列说法中不正确的是( ) 
A.溶液X中一定不含Cu2+、Mg2+、Al3+ , 可能含有Cl﹣
B.OA段参加反应的阴离子的物质的量之比为2:1或1:2
C.AB段一定生成了气体
D.BC段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的摩尔体积比乙的摩尔体积小
B.甲的物质的量比乙的物质的量多
C.甲的相对分子质量比乙的相对分子质量小
D.甲的分子数比乙的分子数少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伞形酮可由雷琐苯乙酮和苹果酸在一定条件下反应制得,下列说法错误的是( ) 
A.雷琐苯乙酮有两种含氧官能团
B.1 mol伞形酮与足量 NaOH溶液反应,最多可消耗2 mol NaOH
C.伞形酮难溶于水
D.雷琐苯乙酮和伞形酮都能跟 FeCl3溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com