
(1)已知:2NO2(g) N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。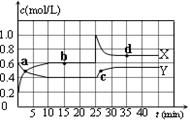
①a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
②前10 min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1。反应在第一个平衡点的平衡常数K(1)= (可用分数表示)。反应在第二个平衡点的平衡常数K(2)与第一个平衡点的平衡常数K(1)的关系:K(2) K(1)(填“>”、“=”或“<”)。
③请在右图坐标中画出1 mol N2O4通入2L的密闭容器中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。
(2)右图中a、b、c、d分别代表氧族元素(ⅥA族):Te(碲)、Se(硒)、S、O氢化物的反应热的数据示意图。试回答下列问题: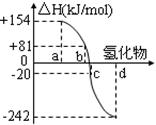
①请你归纳:非金属元素氢化物的稳定性与形成氢化物的反应热△H的关系 。
②写出硒化氢发生分解反应的热化学反应方程式: 。
(1)①b,d ② 0.04(1分) 10/9 =(1分)
③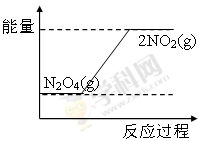 或
或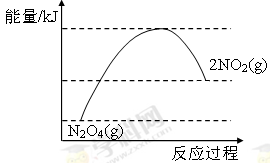
(2)①非金属元素氢化物越稳定,△H越小,反之亦然;②H2Se(g)=Se(s)+H2(g) △H=-81kJ/mol
解析试题分析:(1)①由图可知,10~25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,故答案为:b、d。
②根据化学计量数和图像的变化趋势可知,X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线。由图可知,前10min内,NO2的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,所以υ(NO2)=0.4mol/L÷10min=0.04mol?L-1?min-1。根据图像可知,反应在第一个平衡点是NO2和N2O4的浓度分别是0.6mol/L和0.4mol/L,则该反应的平衡常数K(1)=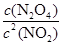 =
=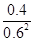 =
=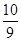 。在25min时NO2的浓度增大,N2O4浓度不变,这说明改变的条件一定不是温度,只能是增大生成物的浓度。平衡常数只与温度有关系,所以平衡常数不变,即K(2)=K(1)。
。在25min时NO2的浓度增大,N2O4浓度不变,这说明改变的条件一定不是温度,只能是增大生成物的浓度。平衡常数只与温度有关系,所以平衡常数不变,即K(2)=K(1)。
③NO2转化为N2O4的反应是放热反应,所以其能量变化示意图为 或
或 。
。
(2)①根据图像可知,Te(碲)、Se(硒)、S、O氢化物的反应热逐渐降低,而氢化物的稳定性逐渐升高,这说明非金属元素氢化物越稳定,△H越小,反之亦然;
②根据图像可知,硒化氢的反应热是+81kJ/mol,所以硒化氢发生分解反应是放热反应,则其热化学反应方程式H2Se(g)=Se(s)+H2(g) △H=-81kJ/mol。
考点:考查考查平衡状态的判断;反应速率与平衡常数的计算与判断;反应热的应用与计算


科目:高中化学 来源: 题型:填空题
据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实。
已知:①CH3CH2OH(l) +3 O2 (g) = 2CO2(g) +3H2O(l) △H=-1366.8 kJ/ mol
②2H2 (g) + O2 (g) = 2H2O(l) △H=" -571.6" kJ/ mol
(1)写出由CO2和H2 反应合成CH3CH2OH (l)和H2O(l)的热化学方程式 。
(2)碱性乙醇燃料电池易储存,易推广,对环境污染小,具有非常广阔的发展前景。该燃料电池中,使用铂作电极,KOH溶液做电解质溶液。请写出该燃料电池负极上的电极反应式为 。
(3)用乙醇燃料电池电解400 mL 饱和食盐水装置可简单表示如下图: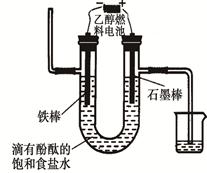
该装置中发生电解反应的方程式为 ;在铁棒附近观察到的现象是 ;当阴极产生448 mL气体(体积在标准状况下测得)时,停止电解,将电解后的溶液混合均匀,溶液的pH为 。(不考虑气体的溶解及溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上合成氨的热反应方程式如下:N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
(1)若已知破坏1mol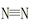 键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。
键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。
(2)在恒温恒压的条件下,将2mol N2和6molH2通入一容积可变的容器中反应,达到平衡后气体的体积为反应前的75%,则该过程释放的能量为 kJ,氮气的转化率为 ,平衡后氨气占混合气体的体积分数为 。
(3)若将1mol N2和1molH2通入两个相同体积的密闭容器甲和乙中,甲容器保持温度和体积不变,乙容器保持温度和压强不变,经过一段时间后,两容器均达到平衡状态。
①建立平衡所需的时间:甲 乙(填“>”,“<”或“=”)
②达到平衡后氨气的体积分数:甲 乙(填“>”,“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氨反应N2(g)+3H2(g) 2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
请回答下列问题:
(1)该反应通常用铁作催化剂,加催化剂会使图中E变_____(填“大”或“小”),E的大小对该反应的反应热有无影响?_ _。理由是_________ ;
(2)图中ΔH=________kJ·mol-1;
(3)起始充入2mol·L-1 N2和5.5 mol·L-1 H2,经过50 min,NH3的浓度为1mol·L-1,
则v(N2)=____________mol·L-1·min-1、C(H2)=______________mol·L-1;
已知NH3(g)= NH3 (l) ΔH=-QkJ·mol-1,书写N2(g)+3H2(g)=2NH3 (l)的热化学方程式 ________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2molNH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是 。
②若起始时向容器内放入2molN2和6molH2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:
1molN-H键断裂吸收的能量约等于 kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
 ?2NH3(g) ΔH2=-92.4 kJ·mol-1
?2NH3(g) ΔH2=-92.4 kJ·mol-1查看答案和解析>>
科目:高中化学 来源: 题型:填空题
汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g)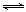 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程)。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程)。
(2)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+ O2(g) = 2NO(g) △H = +180.5kJ/mol
2H2(g)+ O2(g) = 2H2O(l) △H = -571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为 。
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率。右图是反应:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H 0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H 0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。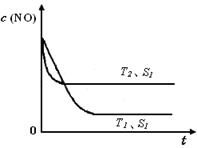
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛。铁还有很多重要的化合物及其化学反应。如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H
(1)上述反应的平衡常数表达式K=_______。
(2) 已知:①3Fe(s)+2O2(g)=Fe3O4(s) △H1=-1118.4kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=-483.8kJ/mol
③2H2(g)+O2(g)=2H2O(l) △H3=-571.8kJ/mol
则△H=_______。
(3)在t0C时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe | H2O(g) | Fe3O4 | H2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| | Fe | H2O(g) | Fe3O4 | H2 |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| | Fe | H2O(g) | Fe3O4 | H2 |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等。
(1)已知:N2(g)+2H2(g)=N2H4(l) △H=" +" 50.6kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H="-571.6" kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l) △H= kJ·mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 。
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 。
(2)采矿废液中的CN-可用H2O2处理。已知:H2SO4=H++ HSO4- HSO4- H++ SO42-
H++ SO42-
用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,S2O82-水解可以得到H2O2。写出阳极上的电极反应式 。
(3)氧化镁处理含NH4+的废水会发生如下反应:
MgO+H2O Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+ Mg2+ +2NH3·H2O。
Mg2+ +2NH3·H2O。
①温度对氮处理率的影响如图所示。在25℃前,升高温度氮去除率增大的原因是 。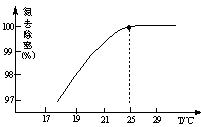
②剩余的氧化镁,不会对废水形成二次污染,理由是 。
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:①取10 mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175 mL②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热③用25 mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol·L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL。则水样中氮的含量是 mg·L-1(用含c、V的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)已知用NaAlO2制备α—Al(OH)3及能量转化关系如图: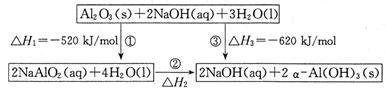
(1)反应②的热化学方程式为 。
(2)根据上述能量转化关系,拜耳公司找到了一种简捷的从铝土矿获取Al2O3的方法,流程如下: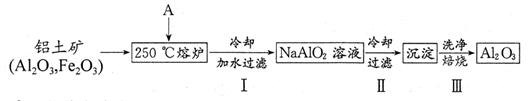
①物质A的化学式为 ;
②步骤Ⅲ的化学反应方程式为 ;检验步骤Ⅲ中沉淀是否洗净的方法是 ;
③步骤Ⅱ采用冷却的方法析出α—Al(OH)3,该措施的依据是 ;
④工业上可电解上述产物Al2O3以获得Al,若获得2.7kgAl,则理论上消耗A的物质的量至少为 mol。有人提出用熔融Na[AlCl4]与NaCl的混合物代替Al2O3进行电解获得Al,则阴极反应为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com