
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2molNH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是 。
②若起始时向容器内放入2molN2和6molH2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:
1molN-H键断裂吸收的能量约等于 kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
 ?2NH3(g) ΔH2=-92.4 kJ·mol-1
?2NH3(g) ΔH2=-92.4 kJ·mol-1(1)①N2(g)+3H2(g)  2NH3(g) ΔH="–92.2" kJ/mol
2NH3(g) ΔH="–92.2" kJ/mol
②< ③391
(2)①< ②c(NH4+)增大,平衡正向移动 ③32%
(3)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=- 906 kJ·mol-1
解析试题分析:(1)N2(g)+3H2(g)  2NH3(g) ΔH="–92.2" kJ/mol该反应为可逆反应,投入2molN2和6molH2并不能完全反应,故Q<184.4KJ。据化学反应的ΔH等于反应物化学键断裂吸收的能量与产物生成化学键放出的能量之差,可算得1molN-H键断裂吸收的能量约等于 391kJ。(2)随着温度的升高,K变小说明正反应为放热反应,所以ΔH<0。(3)根据盖斯定律可求得氨的催化氧化反应的热化学方程式:2①-2②+3 ③
2NH3(g) ΔH="–92.2" kJ/mol该反应为可逆反应,投入2molN2和6molH2并不能完全反应,故Q<184.4KJ。据化学反应的ΔH等于反应物化学键断裂吸收的能量与产物生成化学键放出的能量之差,可算得1molN-H键断裂吸收的能量约等于 391kJ。(2)随着温度的升高,K变小说明正反应为放热反应,所以ΔH<0。(3)根据盖斯定律可求得氨的催化氧化反应的热化学方程式:2①-2②+3 ③
考点:本题考查热化学与化学平衡理论。


科目:高中化学 来源: 题型:填空题
(1)已知:①Fe(s)+1/2O2(g)=FeO(s) △H1=-272.0KJ·mol-1
②2Al(s)+3/2(g)=Al2O3(s) △H2=-1675.7KJ·mol-1
Al和FeO发生铝热反应的热化学方程式是__ __。
某同学认为,铝热反应可用于工业炼铁,你的判断是_ (填“能”或“不能”),你的理由 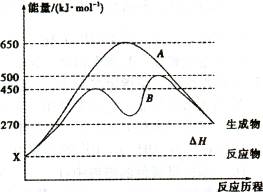
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A.B,如图所示。①据图判断该反应是 (填“吸”或“放” )热反应,当反应达到平衡后,其他条件不变,,升高温度,反应物的转化率将 (填“增大”、 “减小”或“不变”)。
②其中B历程表明此反应采用的条件为
(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知单质硫在通常条件下以S8(斜方硫)的形式存在,而在蒸气状态时,含有S2、S4、S6及S8等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结构如下图所示:
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程和能量关系可用下图简单表示(图中的ΔH表示生成1 mol含硫产物的数据)。
(1)写出表示S8燃烧热的热化学方程式_____________________。
(2)写出SO3分解生成SO2和O2的热化学方程式_________________________。
(3)若已知SO2中硫氧键的键能为d kJ·mol-1,O2中氧氧键的键能为e kJ·mol-1,则S8分子中硫硫键的键能为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)(1)肼(N2H4)是发射航天飞船常用的高能燃料。将NH3和NaClO按一定物质的量比混合反应,生成肼、NaCl和水,该反应的化学方程式是_____________________________。
(2)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量气体,并放出大量热。已知:H2O(l)H2O(g) ΔH=" +44" kJ/mol。12.8 g液态肼与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量。
①请写出液态肼与过氧化氢反应生成液态水的热化学方程式______________________。
②则16 g液态肼与足量过氧化氢反应生成液态水时放出的热量是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用“>”、“<”或“=”填空:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),光照和点燃条件的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1______ΔH2;
(2)相同条件下,2mol氢原子所具有的能量 1mol氢分子所具有的能量;
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_____ΔH2。
①4P(白磷,s) +5O2(g)=2P2O5(s) ΔH1,②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;
(4)已知:101 kPa时,2C(s) +O2(g)=2CO(g) ΔH=-221kJ·mol-1,则碳的燃烧热数值 110.5 kJ·mol-1;
(5)已知:稀溶液中,H+(aq)+OH- (aq)=H2O(l) ΔH=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量 57.3 kJ;
(6)可逆反应:aA(气)+bB(气) cC(气)+dD(气);ΔH=Q,根据图回答:
cC(气)+dD(气);ΔH=Q,根据图回答:
P1 ______ P2;②(a+b)______(c+d);③t1℃______ t2℃。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)已知:2NO2(g) N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。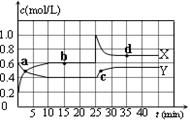
①a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
②前10 min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1。反应在第一个平衡点的平衡常数K(1)= (可用分数表示)。反应在第二个平衡点的平衡常数K(2)与第一个平衡点的平衡常数K(1)的关系:K(2) K(1)(填“>”、“=”或“<”)。
③请在右图坐标中画出1 mol N2O4通入2L的密闭容器中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。
(2)右图中a、b、c、d分别代表氧族元素(ⅥA族):Te(碲)、Se(硒)、S、O氢化物的反应热的数据示意图。试回答下列问题: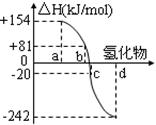
①请你归纳:非金属元素氢化物的稳定性与形成氢化物的反应热△H的关系 。
②写出硒化氢发生分解反应的热化学反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)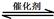 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
①甲烷燃料电池的负极反应式: 。
②电解后溶液的pH= (忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是 L
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知反应:3I-(aq)+S2O82-(aq)  I3-(aq)+2SO42-(aq)+Q
I3-(aq)+2SO42-(aq)+Q
(1)写出反应的平衡常数表达式:K= 。
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q 0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是 曲线。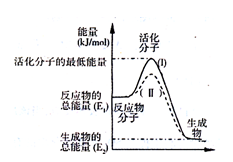
(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。下表是在20℃进行实验时所记录的数据
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol·L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ/mol 请回答下列问题:
(1)生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 572 kJ(填“>”、“<”或“=”)
Ⅱ.已知1molCu(s)与适量O2(g)发生反应,生成CuO(s),放出157kJ热量。写出该反应的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com