
【题目】金属加工后的废切削液中含有2%~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
第一步:NaNO2+NH4Cl===NaCl+NH4NO2
第二步:NH4NO2![]() N2↑+2H2O
N2↑+2H2O
下列对上述反应的叙述中正确的是
①两步均为氧化还原反应 ②第二步NH4NO2仅是还原剂
③NH4NO2发生了分解反应 ④第二步中N2既是氧化产物又是还原产物 ⑤第一步为复分解反应
A. ①③ B. ①④ C. ②③④ D. ③④⑤
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】实验室制取Cl2及性质的验证实验组合装置如下:
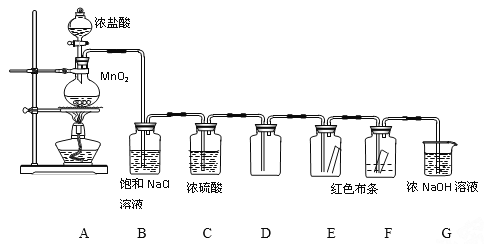
回答下列问题:
(1)A中的化学方程式为____________________________________。
(2)B的作用是除去HCl气体,C的作用是________________________________。
(3)E、F中观察到的现象分别是________________,你得到的结论是________。
(4)G的作用是____________,离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种物质,A、B为无色气体,C、D为黑色粉末,B跟D在一定条件下能生成A,A和D都能跟C反应生成B和一种红色固体E,其中B能跟澄清石灰水反应生成一种白色沉淀F。
(1)根据上述现象,写出下列物质的化学式。
A______________B______________C______________D______________
(2)写出实现下列变化的化学方程式
B + D→A_____________________________________________________
A+ C→E + B_________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm3,溶质的质量分数为ω,溶质的物质的量浓度为C mol / L 。下列叙述中正确的是
①ω=![]() ②C=
②C=![]()
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl―)>c(NH4+)>c(H+)>c(OH―)
A. ②④ B. ②③ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学研制得一种新分子,它具有空心的类似足球状的结构,分子式为C60,下列说法正确的是
A. C60是一种新型的化合物 B. C60含有离子键
C. C60和金刚石互为同位素 D. C60中含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于燃烧热的说法中正确的是
A.1 mol物质燃烧所放出的热量
B.常温下,可燃物燃烧放出的热量
C.在25°C、1.01×105 Pa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量
D.燃烧热随热化学方程式中的化学计量数的改变而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+![]() O2(g)= C4H8(g)+H2O(g) ΔH2=119 kJ·mol1
O2(g)= C4H8(g)+H2O(g) ΔH2=119 kJ·mol1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=242kJ·mol1
O2(g)= H2O(g) ΔH3=242kJ·mol1
反应①的ΔH1为________kJ·mol1。
(2)检验硫酸铁溶液中是否存在Fe2+的方法是_______________________________。
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2= 2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是_____________,每生成l mol Na2FeO4转移________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在特制的密闭真空容器中加入一定量纯净的氨基甲酸铵固体(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是( )
2NH3(g)+CO2(g) ΔH>0。下列说法中正确的是( )
A. 密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态
B. 该反应在任何条件下都能自发进行
C. 再加入一定量氨基甲酸铵,可加快反应速率
D. 保持温度不变,压缩体积,达到新的平衡时,NH3的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液的物质的量浓度的计算正确的是( )
A. V L Fe2(SO4)3 溶液中含Fe3+ m g,溶液中c(SO42—) 是![]() mol·L-1
mol·L-1
B. 将100 mL 1.5 mol·L-1的NaCl溶液与200 mL 2.5 mol·L-1的NaCl溶液混合(忽略溶液体积变化),得到溶液的物质的量浓度为2 mol·L-1
C. 实验室配制480 mL 0.1 mol·L-1的硫酸铜溶液,应选取500 mL容量瓶,称取12.5 g胆矾配成500 mL溶液
D. 标准状况下,a L NH3溶于1000 g水中,得到的溶液密度为b g·cm-3,则该溶液的物质的量浓度为![]() mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com