
【题目】实验室制取Cl2及性质的验证实验组合装置如下:
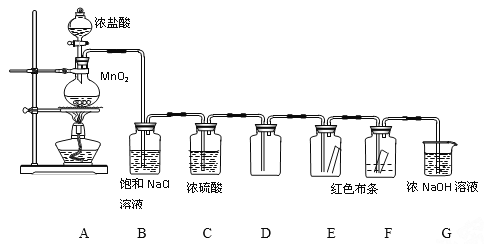
回答下列问题:
(1)A中的化学方程式为____________________________________。
(2)B的作用是除去HCl气体,C的作用是________________________________。
(3)E、F中观察到的现象分别是________________,你得到的结论是________。
(4)G的作用是____________,离子方程式为________________________。
【答案】 4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O 除去氯气中的水蒸气,得到干燥的氯气,防止对E中实验的干扰 E中红色布条不褪色,F中红色布条褪色 说明干燥的Cl2没有漂白性,Cl2与水反应的某种产物具有漂白性 防止尾气中的氯气污染空气 Cl2+2OH-=Cl-+ClO-+H2O
MnCl2+Cl2↑+2H2O 除去氯气中的水蒸气,得到干燥的氯气,防止对E中实验的干扰 E中红色布条不褪色,F中红色布条褪色 说明干燥的Cl2没有漂白性,Cl2与水反应的某种产物具有漂白性 防止尾气中的氯气污染空气 Cl2+2OH-=Cl-+ClO-+H2O
【解析】(1)A中浓盐酸被二氧化锰氧化生成氯气,反应的化学方程式为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O,故答案为:4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O,故答案为:4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)生成的氯气中往往含有氯化氢和水蒸气,B的饱和食盐水了可以除去HCl气体,C中浓硫酸可以干燥氯气,除去水蒸气,防止对E中实验的干扰,故答案为:除去氯气中的水蒸气,得到干燥的氯气,防止对E中实验的干扰;
(3)干燥的氯气没有漂白性,次氯酸具有漂白性,因此E、F中观察到的现象分别是E中红色布条不褪色,F中红色布条褪色,故答案为:E中红色布条不褪色,F中红色布条褪色;干燥的Cl2没有漂白性,Cl2与水反应的某种产物具有漂白性;
(4)氯气有毒,会污染空气,G中的氢氧化钠可以吸收多余的氯气,防止污染空气,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:防止尾气中的氯气污染空气;Cl2+2OH-=Cl-+ClO-+H2O。


科目:高中化学 来源: 题型:
【题目】在日常生活中,下列解决问题的方法不可行的是
A. 为加快漂白粉的漂白速率,使用时可滴加几滴醋酸
B. 为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中
C. 为增强治疗缺铁性贫血效果,可在口服硫酸亚铁片时同服维生素C
D. 为伤口消毒,可在受伤处需抹碘酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取自来水的装置示意图,根据图示回答下列问题。
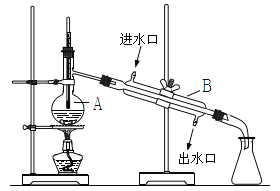
(1)图中的两处明显的错误是____________________、_____________________。
(2)A仪器的名称是______________,B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,还需加入少量___________,其作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图(I)中瓶a内放入20 mL 6mol/L盐酸,b是未充气的气球,里边放有.4 g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气)。将图(I)的装置在托盘天平上称量,质量为W1g。根据实验现象填空:
(1)把气球b中的碳酸钙粉末小心地倒入瓶中,.立即产生许多气泡,气球逐渐胀大〔图11)。反应结束后,再次称量,质量为W2g。则W1和W2的关系是____________。

(2)配置95 mL 6.00mol/L NaOH溶液,需要NaOH固体_______g。在操作中出现下列情况会导致所配置的溶液浓度偏低________。
①氢氧化钠敞口放置②称量左物右码③转移有液体溅出
④读数时仰视⑤没有烘干锥形瓶⑥没有用蒸馏水洗烧杯
(3)取25 mL 6mol/LNaOH溶液,先用滴管取少量NaOH溶液,滴管插入胶管c口(为便于操作,可以适当倾斜瓶a,注意防止漏气。打开d,将溶液挤入瓶中,立即夹紧d。可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失。用同样方法再加入少量NaOH'溶液,又产生白色沉淀,轻摇,沉淀又消失。(提示:滴加溶液时会出现局部溶液过浓)使沉淀产生又消失的离子方程式是________________,________。
(4)将全部NaOH溶液很快加入瓶中,夹紧d,瓶内产生大量白色沉淀,不再溶解。继续轻摇瓶a,气球逐渐缩小,直至恢复反应前的下垂状。写出这时发生的反应的离子方程式:_______________。
(5)标况下气球内最多能产生的气体的体积为____________mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液可能含Cl-、SO42- 、CO32- 、Cu2+.、 Ba2+和Na+。探究小组为了确定该溶液中离子的组成,取该溶液1 00mL进行实验:(填写下表空格)

①_____________;②_________________;③________________;④____________________
若100mL溶液中含有0.3mol Na+,则向步骤三的滤液中加入足量AgNO3溶液,过滤、洗涤、干燥可得到⑤__________g白色沉淀.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=+1 367.0 kJ·mol-1
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1
C.S(s)+O2(g)===SO2(g) ΔH=-269.8 kJ·mol-1
D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是

选项 | W | X |
A | 盐 酸 | Na2CO3溶液 |
B | Cl2 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | NaOH溶液 | AlCl3溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属加工后的废切削液中含有2%~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使亚硝酸钠转化为无毒物质。该反应分两步进行:
第一步:NaNO2+NH4Cl===NaCl+NH4NO2
第二步:NH4NO2![]() N2↑+2H2O
N2↑+2H2O
下列对上述反应的叙述中正确的是
①两步均为氧化还原反应 ②第二步NH4NO2仅是还原剂
③NH4NO2发生了分解反应 ④第二步中N2既是氧化产物又是还原产物 ⑤第一步为复分解反应
A. ①③ B. ①④ C. ②③④ D. ③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com