
【题目】图(I)中瓶a内放入20 mL 6mol/L盐酸,b是未充气的气球,里边放有.4 g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气)。将图(I)的装置在托盘天平上称量,质量为W1g。根据实验现象填空:
(1)把气球b中的碳酸钙粉末小心地倒入瓶中,.立即产生许多气泡,气球逐渐胀大〔图11)。反应结束后,再次称量,质量为W2g。则W1和W2的关系是____________。

(2)配置95 mL 6.00mol/L NaOH溶液,需要NaOH固体_______g。在操作中出现下列情况会导致所配置的溶液浓度偏低________。
①氢氧化钠敞口放置②称量左物右码③转移有液体溅出
④读数时仰视⑤没有烘干锥形瓶⑥没有用蒸馏水洗烧杯
(3)取25 mL 6mol/LNaOH溶液,先用滴管取少量NaOH溶液,滴管插入胶管c口(为便于操作,可以适当倾斜瓶a,注意防止漏气。打开d,将溶液挤入瓶中,立即夹紧d。可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失。用同样方法再加入少量NaOH'溶液,又产生白色沉淀,轻摇,沉淀又消失。(提示:滴加溶液时会出现局部溶液过浓)使沉淀产生又消失的离子方程式是________________,________。
(4)将全部NaOH溶液很快加入瓶中,夹紧d,瓶内产生大量白色沉淀,不再溶解。继续轻摇瓶a,气球逐渐缩小,直至恢复反应前的下垂状。写出这时发生的反应的离子方程式:_______________。
(5)标况下气球内最多能产生的气体的体积为____________mL
【答案】 W2=W1 24.0 g ①③④⑥ Ca2++2OH-= Ca(OH)2 Ca(OH)2+2H+=Ca2++2H2O Ca2++2OH-+CO2=CaCO3↓+H2O 896ml
【解析】试题分析:(1)根据质量守恒定律分析;(2)配置95 mL 6.00mol/L NaOH溶液,用100mL的容量瓶,根据m=cvM计算需要NaOH固体的质量;根据![]() 分析误差;(3) 20 mL 6mol/L盐酸与4 g碳酸钙粉末反应后盐酸有剩余,滴入少量NaOH溶液后,局部溶液氢氧根离子浓度过大,形成微溶物氢氧化钙,轻轻摇动瓶a,氢氧化钙与剩余的盐酸反应生成氯化钙和水;(4)将全部NaOH溶液很快加入瓶中,氢氧化钠过量,溶液吸收气球中的二氧化碳生成碳酸钙沉淀;(5)根据方程式计算碳酸钙与盐酸反应生成二氧化碳的体积。
分析误差;(3) 20 mL 6mol/L盐酸与4 g碳酸钙粉末反应后盐酸有剩余,滴入少量NaOH溶液后,局部溶液氢氧根离子浓度过大,形成微溶物氢氧化钙,轻轻摇动瓶a,氢氧化钙与剩余的盐酸反应生成氯化钙和水;(4)将全部NaOH溶液很快加入瓶中,氢氧化钠过量,溶液吸收气球中的二氧化碳生成碳酸钙沉淀;(5)根据方程式计算碳酸钙与盐酸反应生成二氧化碳的体积。
解析:(1)根据质量守恒定律,反应前后总质量不变,W1=W2;(2)配置95 mL 6.00mol/L NaOH溶液,用100mL的容量瓶, m=cvM=6.00mol/L×0.1L×40g/mol=24.0g;根据![]() , ①氢氧化钠易潮解,氢氧化钠敞口放置,氢氧化钠中含有水,所以氢氧化钠质量偏小,浓度偏低;②称量左物右码,操作正确,浓度不变;③转移有液体溅出,氢氧化钠质量偏小,浓度偏低;④读数时仰视,溶液体积偏大,浓度偏低;⑤没有烘干锥形瓶,无影响;⑥没有用蒸馏水洗烧杯,氢氧化钠质量偏小,浓度偏低;故选①③④⑥。
, ①氢氧化钠易潮解,氢氧化钠敞口放置,氢氧化钠中含有水,所以氢氧化钠质量偏小,浓度偏低;②称量左物右码,操作正确,浓度不变;③转移有液体溅出,氢氧化钠质量偏小,浓度偏低;④读数时仰视,溶液体积偏大,浓度偏低;⑤没有烘干锥形瓶,无影响;⑥没有用蒸馏水洗烧杯,氢氧化钠质量偏小,浓度偏低;故选①③④⑥。
(3) 20 mL 6mol/L盐酸与4 g碳酸钙粉末反应后盐酸有剩余,滴入少量NaOH溶液后,局部溶液氢氧根离子浓度过大,形成微溶物氢氧化钙,轻轻摇动瓶a,氢氧化钙与剩余的盐酸反应生成氯化钙和水,反应离子方程式为Ca2++2OH-= Ca(OH)2 、 Ca(OH)2+2H+=Ca2++2H2O;
(4)将全部NaOH溶液很快加入瓶中,氢氧化钠过量,溶液吸收气球中的二氧化碳生成碳酸钙沉淀,反应离子方程式是Ca2++2OH-+CO2=CaCO3↓+H2O;
(5)4 g碳酸钙粉末的物质的量是![]() ,设碳酸钙与盐酸反应生成二氧化碳的体积是vL;
,设碳酸钙与盐酸反应生成二氧化碳的体积是vL;

![]()
V=0.896L=896mL。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】生产生活中的许多现象或应用都与化学知识有关。下列现象或应用与胶体性质无关的是
A. 将盐卤或石膏加入豆浆中,制成豆腐
B. 冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
C. 泡沫灭火器中将Al2(SO4)3与NaHCO3溶液混合后,喷出大量泡沫,起到灭火作用
D. 清晨,人们经常能看到阳光穿过茂密的树木枝叶所产生的美丽景象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是
A. 沸点:戊烷>2,2-二甲基丙烷>2-甲基丁烷
B. 氢的质量分数:苯>乙烯> 甲烷
C. 密度:溴苯>H2O>苯
D. 等物质的量物质燃烧耗O2量:己烷>苯>C6H5COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列反应:①NH4HCO3溶液与石灰水反应、②K2SO3溶液与稀盐酸反应,③Si与烧碱溶液反应、④Fe与稀硝酸反应,改变反应物用量,不能用同一个离子方程式表示的是( )
A. ①②③ B. ①②④
C. ①③④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、实验室中可以用高锰酸钾和浓盐酸反应制取氯气,化学反应如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)上述反应中的氧化剂是_________,还原剂与还原产物的物质的量之比为______。
(2)如果反应生成5mo1氯气,则过程中转移的电子数为________个。
II、按要求完成离子方程式。
(3)写出向明矾[KAl(SO4)2]溶液中加入氢氧化钡到Al3+完全沉淀的离子方程式:_________。
(4)完成以下氧化还原反应的离子方程式:__________________
( )MnO4 -+( )C2O42- +____ =( )Mn2++( )CO2↑+_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取Cl2及性质的验证实验组合装置如下:
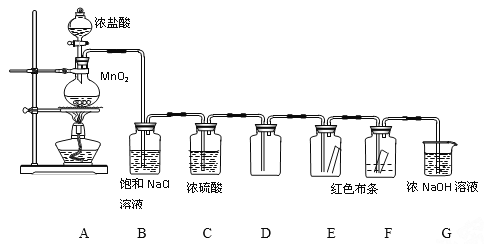
回答下列问题:
(1)A中的化学方程式为____________________________________。
(2)B的作用是除去HCl气体,C的作用是________________________________。
(3)E、F中观察到的现象分别是________________,你得到的结论是________。
(4)G的作用是____________,离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
B | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO |
C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
D | 向浓度均为0.1 mol·L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)> Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm3,溶质的质量分数为ω,溶质的物质的量浓度为C mol / L 。下列叙述中正确的是
①ω=![]() ②C=
②C=![]()
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl―)>c(NH4+)>c(H+)>c(OH―)
A. ②④ B. ②③ C. ①③ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com