
【题目】[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的_________。
②萃取用到的分液漏斗使用前需_______并洗净,分液时有机层在分液漏斗的_____填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是______________;用饱和食盐水洗涤的目的是______________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_____(填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先_______,再______。
【答案】蒸馏 检查是否漏水 上 除去HCl 除去少量NaHCO3且减少产物损失 dcab 拆去连接抽气泵和吸滤瓶的橡皮管 关闭抽气泵
【解析】
间苯三酚和氯化氢的甲醇溶液反应后,生成3,5-二甲氧基苯酚,同时产品中还含有过量的甲醇,HCl和水,然后除去其中的这些杂质即可。
(1)根据表中给出的物理性质数据,除去甲醇可采用蒸馏,之后利用3,5-二甲氧基苯酚易溶于乙醚、微溶于水的性质,加入乙醚进行萃取,静置后分层,乙醚的密度比水小,因而有机层在上层。
(2)分离后的有机层,除了产品3,5-二甲氧基苯酚,还有乙醚,HCl,水。利用这些物质的物理化学性质差异,先加入饱和的NaHCO3溶液洗涤,除去HCl,再加入饱和食盐水除去过量的NaHCO3,同时又减少了产物3,5-二甲氧基苯酚的溶解度,减少溶解的损失。
(3)洗涤后的产品中还有乙醚和水两种杂质。操作是先除水再除乙醚。除水先加入加入无水CaCl2干燥,然后过滤,除去干燥剂,之后蒸馏除去乙醚,再采用重结晶的方法得到纯度较高的产品。正确的顺序是:dcab。
(4)减压过滤时,当漏斗颈下再无液滴滴下时,可判断已抽吸干燥,此时过滤完全,先拔掉连接抽气泵和吸滤瓶的橡皮管,后关抽气泵,以免循环水真空抽气泵中的水倒吸污染滤液。本问要理解减压过滤的原理。


科目:高中化学 来源: 题型:
【题目】A、B和C为常见气体,A是所有气体中密度最小的气体;B是黄绿色气体;C能使湿润的红色石蕊试纸变蓝。D是目前用量最大,用途最广的金属。请回答下列问题:
(1)A是________(填化学式)
(2)实验室制取C时,常用________(填“向下”或“向上”)排空气法收集;
(3)B与D的单质在点燃条件下反应的化学方程式为______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据水解反应离子方程式的书写原则及其注意的问题,判断下列选项正确的是( )
A. FeCl3+3H2O===Fe(OH)3↓+3HCl
B. Al2S3+6H2O![]() 2Al(OH)3+3H2S
2Al(OH)3+3H2S
C. S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。当K闭合后,下列说法正确的有( )
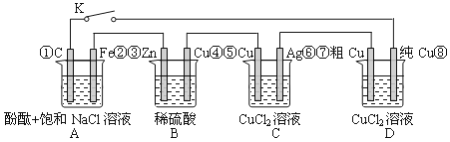
①D装置中纯Cu电极反应为:Cu2++2e-=Cu
②整个电路中电子的流动方向为:③→②;①→⑧;⑦→⑥;⑤→④;
③C装置原理上是一个电镀池(Ag表面镀Cu),期中Cu作阴极,Ag作阳极
④A装置中C电极反应为:O2+4e-+2H2O=4OH-
A. ③④ B. ①② C. ②③④ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池工作时,下列叙述不正确的是
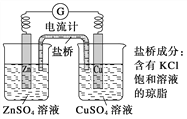
A. 负极反应为Zn-2e-===Zn2+
B. 电池反应为Zn+Cu2+===Zn2++Cu
C. 在外电路中,电子从铜电极流向锌电极
D. 盐桥中的K+移向CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡”![]() 假设盐分以一个NaCl计
假设盐分以一个NaCl计![]() ,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )
,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )

A.海冰内层“盐泡”越多,密度越小
B.海冰冰龄越长,内层的“盐泡”越多
C.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
D.海冰内层NaCl的浓度约为![]() 设冰的密度为
设冰的密度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,易被氧气氧化。利用如图装置,在锥形瓶中加入HCOONa、NaOH、CH3OH和水形成的混合液,通入SO2时发生反应生成保险粉和一种常见气体,下列说法错误的是
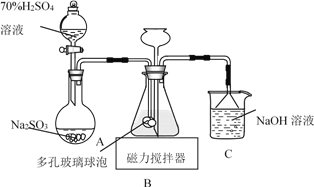
A. 制备保险粉的离子方程式为HCOO-+OH-+2SO2===S2O42-+CO2↑+H2O
B. NaOH溶液的主要作用是吸收逸出的CO2
C. 多孔玻璃球泡的作用是增大气体与溶液的接触面积,使SO2能被充分吸收
D. 为避免产生的Na2S2O4被O2氧化,使硫酸与亚硫酸钠先反应,产生的SO2排出装置中残留的O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. (CH3)3C-CH=CH2与氢气完全反应后,生成2,2,3-三甲基戊烷
B. 工业上由乙烯制乙醇、苯制环己烷均属于加成反应
C. C5H11Cl的同分异构体有3种
D.  分子中所有碳原子一定在同一平面上
分子中所有碳原子一定在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2常用于催化剂。某化学小组在实验室选用下图所示装置 (夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。

已知:①在浓硫酸存在下,加热到140℃时乙醇脱水生成乙醚(C2H5OC2H5),加热到170℃时乙醇脱水生成CH2 = CH2。
②乙醚的熔点为34.6℃,沸点为132℃。
③Mg和Br2剧烈反应,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应 MgBr2 +3C2H5OC2H5 ![]() MgBr2 3C2H5OC2H5。
MgBr2 3C2H5OC2H5。
实验主要步骤如下:
I.选用上述部分装置,正确连接,检查装置的气密性。向装置中加入药品。
II.加热装置A,迅速升温至140℃,并保持140℃加热一段时间,停止加热。
III.通入干燥的氮气,让液溴缓慢进入装置B中,直至完全加入。
IV.装置B中反应完毕后恢复至室温,过滤反应物,将得到的滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
V.用苯洗涤粗产品,减压过滤,得三乙醚合溴化镁,将其加热至160℃分解得无水 MgBr2。
回答下列问题:
(1)装置A中使用仪器m的优点是________。
(2)步骤I中所选装置的正确连接顺序是a________ (填小写字母)。装置D的作用是________。
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是________。
(4)步骤V中用苯洗涤三乙醚合溴化镁的目的是________。
(5)步骤V采用减压过滤(使容器内压强降低,以达到固液快速分离)。下列装置可用作减压过滤的是________(填序号)。

(6)实验中若温度控制不当,装置B中会产生CH2Br—CH2Br。请设计实验验证 CH2Br—CH2Br的存在:从反应后的混合物中分离提纯得到CH2Br—CH2Br,_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com