
| A. | X元素的氢化物的水溶液显碱性 | |
| B. | Z元素的离子半径大于W元素的离子半径 | |
| C. | Z元素的单质在一定条件下能与X元素的单质反应 | |
| D. | Y元素的氧化物是含有极性键的非极性分子 |
分析 X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质,X可能为O,也可能为N元素;Z元素+2价阳离子的核外电子排布与氖原子相同,则Z元素的质子数为10+2=12,故Z为Mg元素;Y元素原子最外电子层上s、p电子数相等,外围电子排布为ns2np2,处于ⅣA族,且属于短周期元素,所以Y为C或Si;W元素原子的M层有1个未成对的p电子,外围电子排布为3s23p1或3s23p5,W为Al或Cl,据此解答.
解答 解:X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质,X可能为O,也可能为N元素;Z元素+2价阳离子的核外电子排布与氖原子相同,则Z元素的质子数为10+2=12,故Z为Mg元素;Y元素原子最外电子层上s、p电子数相等,外围电子排布为ns2np2,处于ⅣA族,且属于短周期元素,所以Y为C或Si元素;W元素原子的M层有1个未成对的p电子,外围电子排布为3s23p1或3s23p5,W为Al或Cl.
A.X可能为O或N,氢化物可以是H2O、NH3、H2O2等,水是中性,H2O2溶液为酸性,故A错误;
B.若W为Cl,镁离子与氯离子最外层电子数相同,电子层越多离子半径越大,镁离子半径小于氯离子半径,若W为Al,镁离子与铝离子电子层结构相同,核电荷数越大,离子半径越小,镁离子半径大于铝离子半径,故B错误;
C.Mg在氮气中燃烧生成Mg3N2,故C正确;
D.若Y为Si,则其氧化物为二氧化硅,属于原子晶体,故D错误,
故选C.
点评 本题考查结构性质位置关系、元素化合物性质、半径比较、晶体结构与性质,难度中等,推断可能的元素是解题关键,注意元素的不确定性,利用列举法进行解答,注意掌握核外电子排布规律.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
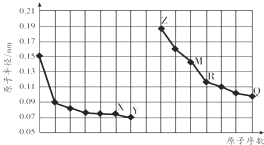
| A. | R在周期表的第15列 | |
| B. | 元素Y气态氢化物的沸点小于元素Q气态氢化物的沸点 | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有极性键的分子一定是极性分子 | |
| B. | 键能越大,表示该分子越容易受热分解 | |
| C. | 在分子中,两个成键的原子间的距离叫做键长 | |
| D. | H-Cl的键能为431.8KJ/mol,H-I的键能为298.7 KJ/mol,这可以说明HCl比HI分子稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②③④ | C. | ①②③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电电池可重复使用是因为所发生的反应可逆向进行 | |
| B. | 充电电池工作时所发生的反应属可逆反应 | |
| C. | 燃料电池的反应物由外设装备提供 | |
| D. | 氢氧燃料电池工作时负极生成的H+向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com