

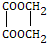 ,据此答题.
,据此答题.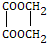 ,
, ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
| A、第9列元素中没有非金属元素 |
| B、只有第2列元素原子最外层有2个电子 |
| C、第1列(H除外)和第17列元素的单质熔沸点变化趋势相反 |
| D、在整个18列元素中,第3列的元素种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、逸出气体若用碱石灰吸收,增重b克,则x偏小 |
| B、把所得溶液加热蒸干并灼烧至恒重,得c克固体,若灼烧时有固体飞溅出去,x偏大 |
| C、某NaOH标准溶液露置于空气中一段时间后,以甲基橙为指示剂滴定上述反应后的溶液,则x偏小 |
| D、产生的气体冷却至室温后,若测定其体积时未调平量气管和水准管内液面,则x偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 反应现象 | |
| 实验结论 | |
| 试管中发生反应的离子方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 目前机动车使用的电池品种不少,其中铅蓄电池的使用量最大.
目前机动车使用的电池品种不少,其中铅蓄电池的使用量最大.| 充电 |
| 放电 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加铁粒质量 |
| B、换成同浓度的稀硫酸 |
| C、改成98%的浓硫酸 |
| D、加入硝酸提高酸的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 分离乙酸乙酯、碳酸钠和水的混合物 分离乙酸乙酯、碳酸钠和水的混合物 |
B、 证明乙醇、浓硫酸共热生成乙烯 证明乙醇、浓硫酸共热生成乙烯 |
C、 实验室制取少量的硝基苯 实验室制取少量的硝基苯 |
D、 证明溴乙烷、NaOH、乙醇溶液共热生成乙烯 证明溴乙烷、NaOH、乙醇溶液共热生成乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com