
| A. | HR溶液中滴加紫色石蕊试液,溶液变红色 | |
| B. | 室温时,NaR溶液的pH大于7 | |
| C. | HR溶液加入少量NaR固体,溶解后溶液的pH变大 | |
| D. | 室温时,0.01 mol•L-1的HR溶液pH=4 |
分析 要证明一元酸HR为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.
解答 解:A.滴加紫色石蕊试液,溶液变红色,说明HR显酸性,但是不能说明是弱酸,故A选;
B.常温下,测得NaR溶液的pH>7,说明NaR为强碱弱酸盐,水解呈碱性,可证明HR为弱酸,故B不选;
C.HR溶液加入少量NaR固体,溶解后溶液的pH变大,说明HR存在电离平衡,则证明HR为弱酸,故C不选;
D.常温下,测得0.01 mol/LHR溶液的pH=4,说明HR没有完全电离,可证明HR为弱酸,故D不选.
故选A.
点评 本题考查实验方案的评价,侧重于弱酸的实验角度的探究,注意把握实验原理和角度,学习中注意相关基础知识的积累.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
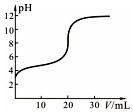 25℃时,用0.1000mol•L-1 KOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液,滴定中pH变化如图,下列关系错误的是( )
25℃时,用0.1000mol•L-1 KOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液,滴定中pH变化如图,下列关系错误的是( )| A. | V=0.00 mL时,CH3COOH溶液pH=3,其电离平衡常数K≈10-5mol•L-1 | |
| B. | V=10.00 mL时,溶液中c(CH3COO-)>c(K+)>c(H+)>c(OH-) | |
| C. | 溶液pH=7时,$\frac{c({K}^{+})•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$=1 | |
| D. | V≥20.00 mL时,溶液中c(K+)=c(CH3COO-)+c(OH-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用纯铜作阳极、粗铜作阴极 | |
| B. | 电解液的成分保持不变 | |
| C. | 屯解过程中,阳极质量的减少与阴明极质量的增加相等 | |
| D. | 阴极电极反应为:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu 溶于稀 HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| B. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 用CH3COOH溶解 CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | FeCl3溶液与Cu反应:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 漂白粉的成分为次氯酸钙和氯化钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| D. | 浓硫酸具有强氧化性,所以浓硫酸可用于干燥H2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
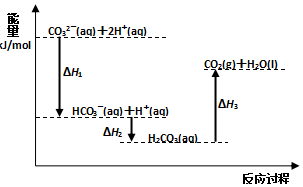
| A. | 反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 为放热反应 | |
| B. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2+△H3) | |
| C. | △H1>△H2△H2<△H3 | |
| D. | H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则△H3变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,12g石墨中含有2NA个C-C键 | |
| B. | 室温下,22.4L正戊烷中含有16NA个σ键 | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 62g P4分子中含有2NA个P-P键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)>c(SO42-)>c(H+)>c(OH-) | B. | c(NH4+)=2c(SO42-) | ||
| C. | c(NH4+)+c(NH3•H2O)=2c(SO42-) | D. | c(NH4+)+c(H+)=c(OH-)+2c(SO42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com