
| A. | c(NH4+)>c(SO42-)>c(H+)>c(OH-) | B. | c(NH4+)=2c(SO42-) | ||
| C. | c(NH4+)+c(NH3•H2O)=2c(SO42-) | D. | c(NH4+)+c(H+)=c(OH-)+2c(SO42-) |
分析 硫酸铵是强酸弱碱盐,NH4+水解而使溶液呈酸性,则c(H+)>c(OH-),再结合电荷守恒、物料守恒判断c(NH4+)、c(SO42-)相对大小,据此分析解答.
解答 解:A.硫酸铵是强酸弱碱盐,NH4+水解而使溶液呈酸性,则c(H+)>c(OH-),水解程度较小,溶液中存在物料守恒,所以存在c(NH4+)>c(SO42-),c(SO42-)>c(H+),故A正确;
B.硫酸铵是强酸弱碱盐,NH4+水解而使溶液呈酸性,则c(H+)>c(OH-),硫酸铵溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),则:c(NH4+)<2c(SO42-),故B错误;
C.硫酸铵溶液中存在物料守恒:c(NH4+)+c(NH3•H2O)=2c(SO42-),故C正确;
D.硫酸铵溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),故D正确;
故选:B.
点评 本题考查离子浓度大小的比较,明确电解质电离方式,盐类水解规律,熟悉溶液中存在的电荷守恒、物料守恒是解题关键,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | HR溶液中滴加紫色石蕊试液,溶液变红色 | |
| B. | 室温时,NaR溶液的pH大于7 | |
| C. | HR溶液加入少量NaR固体,溶解后溶液的pH变大 | |
| D. | 室温时,0.01 mol•L-1的HR溶液pH=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液中滴加AgNO3溶液 | B. | Na2CO3溶液中滴加盐酸 | ||
| C. | CH3COOH溶液中滴加氨水 | D. | CuSO4溶液中滴加Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现象 | 解释或结论 | |
| A | 无色试剂瓶中的浓硝酸呈现黄色 | 硝酸不稳定,分解生成NO2的溶解在其中 |
| B | 在玻璃导管口点燃氢气,火焰呈黄色 | 氢气燃烧 |
| C | 某无色溶液中滴加氯水和四氯化碳,振荡、静置,下层出现紫色 | 溶液中含有碘离子 |
| D | 向CuSO4溶液中通入H2S,有黑色沉淀生成 | 有难溶的CuS生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质灼烧时,焰色反应为黄色,该物质一定是钠的化合物 | |
| B. | 向10mL0.05mol/LKAl(SO4)2溶液中滴加10mL0.1mol/LBa(OH)2溶液,反应后铝元素的主要存在形式是Al3+和Al(OH)3 | |
| C. | AlCl3和NaOH;HCl和NaAlO2;Na2CO3和HCl都可以不用其他试剂能鉴别出来 | |
| D. | 下列四个变化中①④可以通过一步实验直接完成①AlO2-→Al3+②Al2O3→Al(OH)3③Al3+→AlO2-④AlCl3→Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
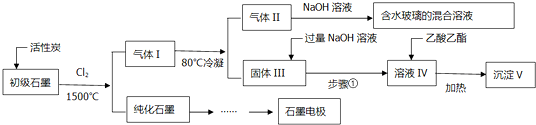
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气质量状况属于重度污染的地区,所有人的健康都会受到严重影响 | |
| B. | 二氧化硫、氮氧化物、悬浮颗粒(pM)是雾霾的主要污染物,前两者是气态污染物,PM才是加重雾霾天气污染的罪魁祸首 | |
| C. | pM2.5(可吸入颗粒物)成份很复杂,并具有较强的吸附能力,随吸入空气而进入肺部,从而影响健康 | |
| D. | 气象环境报告中新增的PM2.5是一种新的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Na+ | Mg2+ | Al3+ |
| 浓度/mol•L-1 | 0.5 | 1.0 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com