
下列反应与酸性氧化物的通性无关的是
| A.实验室用碱石灰吸收SO2 |
| B.Na2O2与水反应制备氧气 |
| C.N2O5与水反应制备HNO3 |
| D.CO2与澄清石灰水作用 |
B
解析试题分析:碱石灰的主要成分是NaOH和CaO,前者是强碱,后者是碱性氧化物,SO2与NaOH、CaO都能反应生成盐,说明SO2是酸性氧化物,具有酸性氧化物的通性,故A错误;过氧化钠与水反应制备氧气是氧化还原反应,存在化合价变化,与酸性氧化物的通性无关,故B正确;五氧化二氮与水发生化合反应或非氧化还原反应,生成硝酸,说明五氧化二氮是酸性氧化物,与酸性氧化物的通性有关,故C错误;澄清石灰水的溶质是氢氧化钙,Ca(OH)2是强碱,CO2与Ca(OH)2反应生成盐和水,说明CO2是酸性氧化物,与酸性氧化物的通性有关,故D错误。
考点:考查酸性氧化物的通性,涉及与强碱、碱性氧化物反应生成盐、与水反应生成酸的非金属氧化物的性质等知识。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:单选题
对下列物质用途的解释不正确的是( )
| | A | B | C | D |
| 用途 | 抗坏血酸(Vc)可作抗氧化剂 | 明矾可用于净水 | 纯碱可去油污 | “84”消毒液可用于漂白 |
| 解释 | Vc具有酸性 | 明矾在水中生成的氢氧化铝胶体有吸附性 | 纯碱水解呈碱性 | 置于空气中生成的次氯酸有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
中学化学常见物质甲、乙、丙、丁之间存在转化关系:甲+乙→丙+丁。下列说法正确的是
| A.若甲为铜,丁为氯化亚铁,则乙一定是氯化铁 |
| B.若甲为碳,丁为硅,则丙一定是二氧化碳 |
| C.若甲为铝,丁为铁,则乙一定是氧化铁 |
| D.若甲为镁,丁为氢气,则乙一定是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关物质的性质与应用均正确的是
| A.常温下Cl2能与强碱溶液反应,工业生产和实验室可用澄清石灰水吸收氯气尾气 |
| B.苯酚遇FeCl3溶液显紫色,可用FeCl3溶液检验工业生产的废水中是否存在苯酚 |
| C.铜的金属活动性比铁的弱,可在海轮外壳上装若干铜块以减缓船体的腐蚀速率 |
| D.碳酸钠溶液与硫酸钙能发生复分解反应,可用硫酸钠溶液清除锅炉水垢中的碳酸钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据下列有关实验得出的结论一定正确的是
| 选项 | 方法 | 结论 |
| A | 同温时,等质量的锌粒分别与足量稀硫酸反应 | 产生氢气量:加过胆矾=没加胆矾 |
| B | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,则溶液变黄 | 氧化性:H2O2>Fe3+ |
| C | 相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 | 反应速率:粉状大理石>块状大理石 |
| D | 向2mL 0.1mol·L-1Na2S溶液中滴入几滴0.1mol·L-1ZnSO4溶液,有白色沉淀生成;再加入几滴0.1mol·L-1 CuSO4溶液,则又有黑色沉淀生成 | 溶度积(Ksp):ZnS>CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列陈述I、II正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | Br2蒸气和NO2都是红棕色气体 | 可用淀粉碘化钾水溶液鉴别 |
| B | BaSO4和BaCO3都是难溶物 | 医疗上都能用作“钡餐” |
| C | 硬铝是合金 | 其熔点比金属铝的熔点低 |
| D | 电镀时阴极上发生还原反应 | 可在铁的镀件上镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列陈述I、II正确且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | SO2有漂白性 | SO2可使酸性高锰酸钾溶液褪色 |
| B | 硫酸铜是强酸弱碱盐 | 蒸干CuSO4溶液可以得到Cu(OH)2固体 |
| C | SO2是酸性氧化物 | 将SO2通入BaCl2溶液可生成BaSO3沉淀 |
| D | 氢氧化铝显两性 | 向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaOH溶液,沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验操作及现象能够达到对应实验目的的是
| 选项 | 实验操作及现象 | 实验目的 |
| A | 将SO2通入品红溶液中,品红溶液褪色;加热褪色后的品红溶液,溶液恢复红色 | 验证亚硫酸的不稳定性 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下 Ksp(BaCO3)>Ksp(BaSO4) |
| C | 常温下,测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水溶液中HCl电离程度大于CH3COOH |
| D | 将浓硫酸与碳混合加热,直接将生成的气体通入足量的石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
稀土元素是周期表中Ⅲ B族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。
我国蕴藏着丰富的钇矿石( Y2 FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下: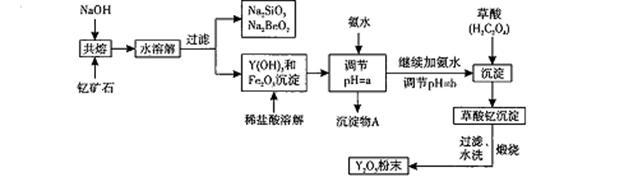
已知:
I.有关金属离子形成氢氧化物沉淀时的pH如下表:
| | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com