
| A. | Na2CO3可用于治疗胃酸过多 | B. | 水玻璃浸泡过的木材能防腐 | ||
| C. | 明矾用于饮用水消毒 | D. | 晶体硅用于制造光导纤维 |
分析 A.碳酸钠碱性强;
B.水玻璃为硅酸钠的水溶液,硅酸钠熔点高,不易燃烧;
C.明矾溶于水电离产生的铝离子水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性,能够吸附水中固体杂质颗粒;
D.光导纤维主要原料为二氧化硅.
解答 解:A.碳酸钠碱性较强,不能用于中和胃酸过多,治疗胃酸过多可以用碳酸氢钠,故A错误;
B.水玻璃为硅酸钠的水溶液,硅酸钠熔点高,不易燃烧,水玻璃浸泡过的木材能防腐,故B正确;
C.明矾溶于水电离产生的铝离子水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性,能够吸附水中固体杂质颗粒,可以净水,明矾不具有杀菌消毒的作用,故C错误;
D.二氧化硅具有良好的光学特性,是制造光导纤维主要成分,故D错误;
故选:B.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,明确相关物质的性质是解题个?,侧重于基础知识的综合理解和运用的考查,难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作及现象 |
| A | 检验1-溴丙烷中含有溴 | 将1-溴丙烷与足量氢氧化钠溶液混合加热,冷却后加硝酸银溶液,得沉淀 |
| B | 验证样品中一定含有苯酚 | 向样品溶液中滴加氯化铁溶液后显紫色 |
| C | 验证蔗糖没有水解 | 在蔗糖溶液中加入稀硫酸,水浴加热一段时间后,加入少量新制Cu(OH)2悬浊液,加热后未出现砖红色沉淀 |
| D | 证明蛋白质的变性是不可逆的 | 向蛋白质溶液中滴加CuSO4溶液,有固体析出,过滤,向固体中加足量水,固体不溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
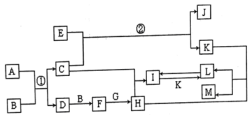
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
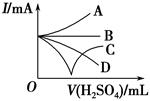 向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下钠能与水反应,因此钠与硫酸铜溶液反应不能得到单质铜 | |
| B. | 过氧化钠与水或二氧化碳反应都能生成氧气,因此过氧化钠常用于呼吸面具或潜艇中作为氧气的来源 | |
| C. | 铜盐、铝盐、铁盐在天然水中都能形成胶体,能使天然水中的泥沙等形成絮状不溶物沉降下来,使水澄清,所以铜盐、铝盐、铁盐都可用作净水剂 | |
| D. | 合金具有许多优良的物理、化学或机械性能,合金的硬度可以大于它的纯金属成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氧化钠溶液鉴别MgCl2溶液、AlCl3溶液 | |
| B. | 利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液 | |
| C. | 用干燥的红色石蕊试纸鉴别NH3和HCl气体 | |
| D. | 用氯化钙溶液鉴别Na2CO3溶液和NaHCO3两种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
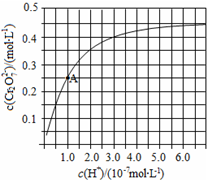 铬是用途广泛的金属元素.
铬是用途广泛的金属元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com