
科目:高中化学 来源:不详 题型:填空题
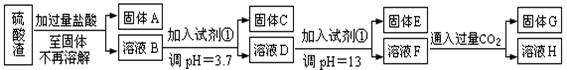
| A.氢氧化钠 | B.氧化铝 | C.氨水 | D.水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
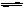 Ca2+(aq)+2OH-(aq),Ksp=4.7×10-6 mol3/L3,下列措施可使Ksp增大的是( )
Ca2+(aq)+2OH-(aq),Ksp=4.7×10-6 mol3/L3,下列措施可使Ksp增大的是( )| A.升高温度 | B.降低温度 |
| C.加入适量CaO固体 | D.加入适量Na2CO3固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgCl=AgI=Ag2S | B.AgCl<AgI<Ag2S |
| C.AgCl>AgI>Ag2 S | D.AgI>AgCl>Ag2S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
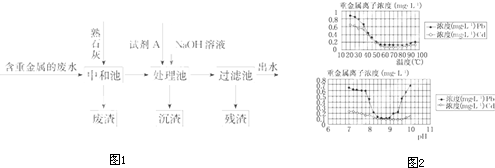
| Cu(OH)2 | CuS | FeS | PbS | HgS | CdS |
| 2.2×10-20 | 8.5×10-45 | 6.3×10-18 | 3.4×10-28 | 4×10-53 | 8×10-29 |
查看答案和解析>>
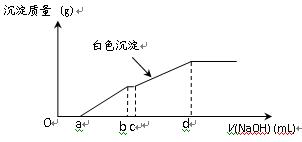
科目:高中化学 来源:不详 题型:单选题
| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32-) |
| C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32-) |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.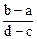 | B.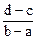 |
C.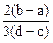 | D.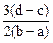 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com