


分析 (1)调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,可以使之转化为氢氧化物沉淀而除去,根据保证不引入杂质离子来选择合适的调节pH值的试剂;
(2)根据蒸发操作所需仪器来回答;
(3)根据温度过高会导致实验误差来回答;
(4)①根据气压原理来判断装置的气密性情况;
②根据实验原理,保证碳酸钙和盐酸反应产生的二氧化碳的放出是关键;
③碳酸钙和盐酸反应产生的二氧化碳的量不能受外界空气中二氧化碳和水的干扰;
④根据实验的原理结合化学反应进行计算即可.
解答 解:(1)调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,可以使之转化为氢氧化物沉淀而除去滤渣的主要成分是氢氧化铝和氢氧化铁,为了保证不引入杂质离子,所以中和盐酸的酸性调节pH值可以用氧化钙或是碳酸钙,故答案为:Fe(OH)3、Al(OH)3;AB;
(2)根据蒸发操作所需仪器有玻璃棒、蒸发皿、酒精灯、三脚架,故答案为:玻璃棒和蒸发皿;
(3)根据温度过高会导致双氧水分解,引起实验误差,故答案为:温度过高会导致双氧水分解;
(4)①根据气压原理来判断装置的气密性,方法是关闭导管出口以及分液漏斗的瓶塞,打开分液漏斗的旋塞,液体不往下滴,证明气密性良好,故答案为:关闭导管出口以及分液漏斗的瓶塞,打开分液漏斗的旋塞,液体不往下滴,证明气密性良好;
②根据实验原理,保证碳酸钙和盐酸反应产生的二氧化碳的放出是关键,所以从A装置通入空气,目的是保证碳酸钙和盐酸反应产生的二氧化碳全部进入下一个装置,故答案为:让生成的二氧化碳全部放出,进入C装置,确保实验结果的准确性;
③碳酸钙和盐酸反应产生的二氧化碳的量不能受外界空气中二氧化碳和水的干扰,装置D的作用为防止空气中的二氧化碳进入装置C中,引起实验误差,故答案为:防止空气中的二氧化碳进入装置C中,引起实验误差;
④根据碳酸钙中碳元素守恒,碳酸钙中的碳元素先成为二氧化碳,然后是二氧化碳在和氢氧化钡反应得到碳酸钡沉淀,碳酸钡中的碳元素全部来自碳酸钙中,所以17.73gBaCO3沉淀的物质的量为17.73g÷197g•mol-1=0.09mol,所以碳酸钙的物质的量是0.09mol,质量是9g,百分含量是9g÷10.00g×100%=90.00%,故答案为:90.00%.
点评 本题是以制备过氧化钙为载体,考查实验的设计与评价,涉及实验的基本操作和实验原理的理解,要求学生具有分析和解决问题的能力,难度大.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
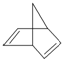 ,其分子式为C7H8.
,其分子式为C7H8. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
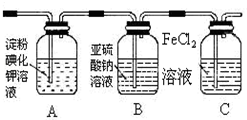
| 实验步骤 | 预期现象和结论 |
步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2mol/LHCl和1mol/LBaCl2溶液 振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42- |
步骤2:另取适量洗气瓶B中溶液于试管B中,滴加滴加入过量lmol/LBa(NO3)2溶液 振荡,静置. | 产生白色沉淀. |
步骤3:取步骤2后试管B中的上层清液于试管C中, 滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡.. | 若产生白色沉淀,则洗气瓶B溶液中存在氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外有25个电子 | |
| B. | 是一种新元素 | |
| C. | 核内有15个质子,核外有10个电子 | |
| D. | 质量数为25,原子序数为15,核内有10个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH<7的溶液:Cu2+、Na+、Mg2+、NO3- | |
| B. | 滴加酚酞试液显红色的溶液:Fe3+、NH4+、Cl-、NO3- | |
| C. | 所含溶质为NaOH的溶液中:K+、SO42-、NO3-、H+ | |
| D. | 在碱性溶液:K+、HCO3-、Br-、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法, 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 分子是为C5H12O且可与金属钠反应放出氢气的有机物有 (不考虑立体异构) 8种 | |
| D. | 某单炔烃,氢化后的产物结构简式为: ,则该烃可能有的结构有4种 ,则该烃可能有的结构有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
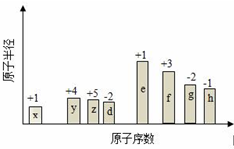 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 香精里面含有酯类物质,工业上以A为主要原料来合成酯C4H8O2,其合成路线如图所示.其中A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.又知2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.
香精里面含有酯类物质,工业上以A为主要原料来合成酯C4H8O2,其合成路线如图所示.其中A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.又知2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.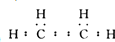
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15mol•L-1•min-1 | B. | 0.3mol•L-1•min-1 | ||
| C. | 0.45mol•L-1•min-1 | D. | 0.6mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com