
 香精里面含有酯类物质,工业上以A为主要原料来合成酯C4H8O2,其合成路线如图所示.其中A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.又知2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.
香精里面含有酯类物质,工业上以A为主要原料来合成酯C4H8O2,其合成路线如图所示.其中A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.又知2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.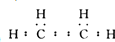
 .
. 分析 A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,CH3CHO进一步氧化可得D为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成CH3COOCH2CH3.
解答 解:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,CH3CHO进一步氧化可得D为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成CH3COOCH2CH3.
(1)A为乙烯,其电子式为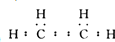 ,故答案为:
,故答案为: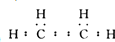 ;
;
(2)B为乙醇,含有官能团为羟基,D为乙酸,含有官能团为羧基,故答案为:羟基;羧基;
(3)反应①是乙烯与水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,
反应②是乙醇发生氧化反应生成乙醛,反应方程式为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,
反应④是乙醇与乙酸发生酯化反应生成乙酸乙酯,也属于取代反应,反应方程式为:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$H3CH2OH,加成反应;
2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,氧化反应;
CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,酯化反应或取代反应;
(5)乙烯发生加聚反应生成聚乙烯,反应的化学方程式: ,
,
故答案为: .
.
点评 本题考查有机物的推断,涉及烯、醇、醛、羧酸等的性质与转化等,难度不大,注意对基础知识的理解掌握.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠和水反应:2Na2O2+2 H2O=4Na++4OH-+O2↑ | |
| B. | 氧化铝溶于氢氧化钠溶液:Al2O3+2 OH-=2AlO2-+H2↑ | |
| C. | 氢氧化钡溶液滴入稀硫酸中:Ba2++OH一+H++SO42-=BaSO4↓+H2O | |
| D. | 二氧化碳通入足量氢氧化钠溶液:CO2+OH-=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
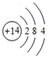 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
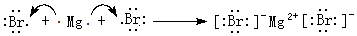 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从1L1mol/L的NaCl溶液中取出500 ml,其浓度是0.5mol/L | |
| B. | 制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况) | |
| C. | 0.5L 2mol/LBaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 | |
| D. | 10g 98%硫酸(密度为1.84g/cm3)与1OmL 18.4mol/L硫酸的浓度是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Ag+、NO3-、SO42- | B. | Mg2+、NH4+、NO3-、Cl- | ||
| C. | Cu2+、Cl-、NO3-、Cl- | D. | K+、Na+、ClO-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从食盐溶液中获得食盐晶体采用降温结晶的方法 | |
| B. | 除去酒精中含有的少量水采用蒸馏的方法 | |
| C. | 除去氯化钠溶液中少量的泥沙用蒸馏的方法 | |
| D. | 从碘水中获得碘的晶体采用过滤的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com