
【题目】已知:实验室常用无水乙醇(CH3CH2OH)制备乙烯,制备原理为:CH3CH2OH ![]() CH2=CH2↑+H2O.
CH2=CH2↑+H2O.
无水乙醇性质如表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 挥发性 | 化学性质 |
无水乙醇 | ﹣114.1 | 78.3 | 能与水以任意比互溶 | 易挥发 | 能使酸性高锰酸钾溶液褪色 |
甲、乙同学用下列实验装置制备乙烯并验证其性质.(气密性已检验,部分夹持装置略).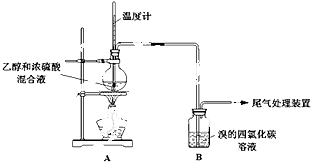
实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 |
… | |
实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)写出乙烯的1个用途: , 对应方程式为(注明反应类型) .
(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有性.
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型) .
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种“有刺激性气味”的气体X.你认为这种“有刺激性气味”气体X是(填化学式).
(5)为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
设 计 | 现 象 |
与A连接的装置如下: | C中溶液褪色,加热后又恢复红色; |
请回答下列问题:
D中盛放的试剂是(填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释): .
【答案】
(1)制塑料;![]() ,加聚反应
,加聚反应
(2)脱水
(3)CH2=CH2+Br2→CH2BrCH2Br,加成反应
(4)SO2
(5)NaOH;5C2H4+4MnO4﹣+12H+→10CO2↑+4Mn2++16H2O
【解析】解:(1.)聚乙烯是重要的化工原料,可以制备聚乙烯塑料,乙烯分子间发生加成聚合反应生成高分子化合物聚乙烯;反应的化学方程式为: ![]() ,反应类型为加成聚合反应,所以答案是:制塑料;
,反应类型为加成聚合反应,所以答案是:制塑料; ![]() ,加聚反应;
,加聚反应;
(2.)A中烧瓶内是乙醇和浓硫酸混合溶液,加热反应,溶液“渐渐变黑”,说明浓硫酸具有脱水性,可以使乙醇脱水炭化变黑色,所以答案是:脱水性;
(3.)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,是乙烯和溴单质发生的加成反应生成1,2﹣二溴乙烷,该反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,反应类型为加成反应,所以答案是:CH2=CH2+Br2→CH2BrCH2Br,加成反应;
(4.)乙烯在浓硫酸作用下脱水得到碳,碳和浓硫酸加热反应生成二氧化碳、二氧化硫气体,刺激性气味的气体为二氧化硫气体 所以答案是:SO2.
(5.)为验证气体二氧化硫的存在,并证实是C2H4使B中溴的四氯化碳溶液褪色,分析装置可知装置C中品红溶液检验二氧化硫气体的存在,装置D是氢氧化钠溶液用来吸收二氧化硫气体和二氧化碳气体,装置E是干燥乙烯气体通过装置F中溴的四氯化碳溶液褪色证明乙烯的生成,最后进行尾气吸收,D中若放高锰酸钾溶液会吸收乙烯发生氧化还原反应,反应的离子方程式为:5C2H4+4MnO4﹣+12H+→10CO2↑+4Mn2++16H2O,所以答案是: NaOH;5C2H4+4MnO4﹣+12H+→10CO2↑+4Mn2++16H2O.


科目:高中化学 来源: 题型:
【题目】X是一种日常生活中常见的金属,它既能与盐酸反应生成X3+和H2,又能与烧碱溶液反应生成XO2-和H2O.X的氢氧化物具有两性,但不与氨水反应;而Zn(OH)2与氨水反应生成[Zn(NH3)4]2+.试回答下列问题:
(1)X元素在元素周期表中的位置是______。
(2)X的氧化物也具有两性,写出其溶于烧碱溶液的离子方程式:_______。
(3)分离X3+与Zn2+的最佳方法是加入过量的____________。
(4)与O同周期的第VA族元素Z形成的最常见氢化物也可表示为ZH3,Z还可形成多种氢化物及其微粒,如Z2H4、Z2H5+、ZH4+等.
①写出Z2H4的电子式:________。
工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(Z2H4·H2O)、Na2CO3等产物,则该反应的化学方程式为_________。
查资料得,在高温下肼可将锅炉内壁表面的铁锈转化为致密的氧化膜。取3.2g肼与96g该铁锈样品(可看作是Fe2O3)在搞完下恰好完全反应生成氮气等产物,写出该反应的化学方程式:_______。
②若某一物质组成为Z4H4,则它的一种离子化合物的化学式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源开发利用的部分过程如图所示:

下列说法不正确的是
A. 海水淡化的常用方法有蒸馏法、 电渗析法和离子交换法
B. 可通过分液的方法分离溴单质和苯的混合物
C. 提纯时,所加试剂可依次为 BaCl2、 NaOH、 Na2CO3、盐酸
D. 精盐、 NH3和 CO2是侯德榜制碱工业的主要原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以空气和镁为原料制备 Mg3N2 的装置如图所示(夹持和加热装置略去):
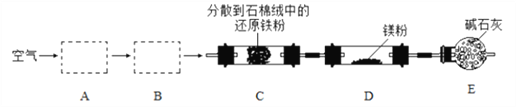
下列说法正确的是
A. 装置 A、B 中可依次加入浓硫酸、NaOH 溶液
B. 装置 E 中碱石灰的作用是吸收尾气
C. 实验时, 应先加热 C,通入一段时间空气后再加热D
D. 若去掉装置 C,对产品纯度无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定的温度下,向一个容积为2L的恒容密闭容器中(事先装入催化剂),充入2molN2和3molH2 , 3min后测得密闭容器内的压强是起始时的0.9倍.在这段时间内,用H2表示该反应的平均反应速率是( )
A.0.125molL﹣1min﹣1
B.0.100 molL﹣1s﹣1
C.0.200 molL﹣1min﹣1
D.0.375 molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 摩尔是国际科学界建议采用的一种物理量
B. 摩尔是物质的量的单位,简称摩,符号为mol
C. 摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D. 氢氧化钠的摩尔质量是40
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应 
请回答下列问题:
(1)分別写出E、F的电子式:E , F;
(2)实验室制J的化学方程式 .
(3)由F制取B的反应中,每产生标准状况下11.2L的B,转移电子的物质的量为;
(4)在C、D、E.、I、J分子中,以极性键结合的是(填相应的字母,下同),以非极性键结合的是;
(5)用电子式表示I的形成过程;
(6)现将标准状况下1.12L二氧化碳通入60mL 1mol/L的A的最高价氧化物对应的水化物溶液中,则反应后溶液中溶质的物质的量之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com