
【题目】如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应 
请回答下列问题:
(1)分別写出E、F的电子式:E , F;
(2)实验室制J的化学方程式 .
(3)由F制取B的反应中,每产生标准状况下11.2L的B,转移电子的物质的量为;
(4)在C、D、E.、I、J分子中,以极性键结合的是(填相应的字母,下同),以非极性键结合的是;
(5)用电子式表示I的形成过程;
(6)现将标准状况下1.12L二氧化碳通入60mL 1mol/L的A的最高价氧化物对应的水化物溶液中,则反应后溶液中溶质的物质的量之比为 .
【答案】
(1)![]() ;
;![]()
(2)Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(3)1mol
(4)I、J;C、D、E
(5)![]()
(6)n(Na2CO3):n(NaHCO3)=1:4
【解析】解:化合物G的焰色反应为黄色,含有Na元素,F能与二氧化碳反应得到气体单质B与G,可推知F为Na2O2 , B为O2 , G为Na2CO3 , 而A与B(氧气)反应得到F(过氧化钠),则A为Na,G(Na2CO3)与I反应得到CO2 , 则I属于酸,I由气体非金属单质C与D在光照条件下得到,则I为HCl,C、D分别为H2、Cl2中的一种,I和J通常状况下呈气态,二者反应得到铵盐,且反应①是化工生产中的一种重要固氮反应,可推知J为NH3 , D为H2 , E为N2 , 铵盐为NH4Cl,C为Cl2 , (1)由上述分析可知,物质E为N2 , 其电子式为 ![]() ;F为Na2O2 , 过氧化钠为离子化合物,其电子式为
;F为Na2O2 , 过氧化钠为离子化合物,其电子式为 ![]() , 所以答案是:
, 所以答案是: ![]() ;
; ![]() ;(2)J为NH3 , 固体氯化铵和固体氢氧化钙反应的方程式为:Ca(OH)2+2NH4Cl
;(2)J为NH3 , 固体氯化铵和固体氢氧化钙反应的方程式为:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O,
CaCl2+2NH3↑+2H2O,
所以答案是:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O;(3)F为Na2O2 , B为O2 , F和CO2的反应方程式为:2Na2O2+2CO2=2Na2CO3+O2 , 标况下11.2L氧气的物质的量为:
CaCl2+2NH3↑+2H2O;(3)F为Na2O2 , B为O2 , F和CO2的反应方程式为:2Na2O2+2CO2=2Na2CO3+O2 , 标况下11.2L氧气的物质的量为: ![]() =0.5mol,生成0.5mol氧气转移电子的物质的量为:0.5mol×2=1mol,所以答案是:1mol;(4)C为Cl2、D为H2、E为N2、I为HCl、J为NH3 , 不同非金属元素之间形成极性共价键,同种非金属元素之间形成极性共价键,则以极性键结合的是I、J,以非极性键结合的是C、D、E,
=0.5mol,生成0.5mol氧气转移电子的物质的量为:0.5mol×2=1mol,所以答案是:1mol;(4)C为Cl2、D为H2、E为N2、I为HCl、J为NH3 , 不同非金属元素之间形成极性共价键,同种非金属元素之间形成极性共价键,则以极性键结合的是I、J,以非极性键结合的是C、D、E,
所以答案是:I、J;C、D、E;(5)I为HCl,氯化氢为共价化合物,用电子式表示其形成过程为 ![]() ,所以答案是:
,所以答案是: ![]() ;(6)A为Na,其最高价氧化物对应水合物为NaOH,标况下1.12L二氧化碳的物质的量为:
;(6)A为Na,其最高价氧化物对应水合物为NaOH,标况下1.12L二氧化碳的物质的量为: ![]() =0.05mol,
=0.05mol,
60mL 1mol/L的NaOH溶液中含有氢氧化钠的物质的量为:1mol/L×0.06L=0.06mol,
NaOH与二氧化碳的物质的量之比=0.06mol:0.05mol=6:5,则反应后溶质为碳酸钠和碳酸氢钠的化合物,设Na2CO3、NaHCO3的物质的量分别为x、y,
则: ![]() ,
,
解得: ![]() ,
,
所以n(Na2CO3):n(NaHCO3)=0.01mol:0.04mol=1:4,
所以答案是:n(Na2CO3):n(NaHCO3)=1:4.


科目:高中化学 来源: 题型:
【题目】等质量的铝粉,分别与等体积的氢氧化钠溶液和硫酸恰好完全反应,则氢氧化钠溶液和硫酸的物质的量浓度之比是( )
A.2:3B.3:2C.1:1D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:实验室常用无水乙醇(CH3CH2OH)制备乙烯,制备原理为:CH3CH2OH ![]() CH2=CH2↑+H2O.
CH2=CH2↑+H2O.
无水乙醇性质如表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 挥发性 | 化学性质 |
无水乙醇 | ﹣114.1 | 78.3 | 能与水以任意比互溶 | 易挥发 | 能使酸性高锰酸钾溶液褪色 |
甲、乙同学用下列实验装置制备乙烯并验证其性质.(气密性已检验,部分夹持装置略).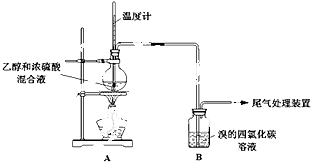
实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 |
… | |
实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)写出乙烯的1个用途: , 对应方程式为(注明反应类型) .
(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有性.
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型) .
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种“有刺激性气味”的气体X.你认为这种“有刺激性气味”气体X是(填化学式).
(5)为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
设 计 | 现 象 |
与A连接的装置如下: | C中溶液褪色,加热后又恢复红色; |
请回答下列问题:
D中盛放的试剂是(填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释): .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的应用中,利用了该物质氧化性的是( )
A.液氨——作制冷剂
B.甘油——作护肤保湿剂
C.FeCl3——用于铜制印刷版的制作
D.食醋——除去水壶中的水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
A. 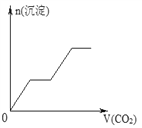 B.
B. 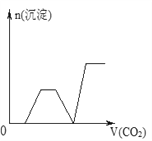
C. 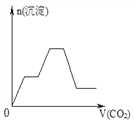 D.
D. 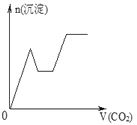
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷和乙烯的说法中正确的是
A. 乙烯在空气中燃烧,出现明亮的蓝紫色火焰
B. 乙烯使酸性KMnO4溶液褪色是因为乙烯被酸性KMnO4溶液氧化
C. 甲烷与氯气光照条件下反应生成的三氯甲烷常温下是气态
D. 乙烯分子中含一个碳碳双键和两个碳氢单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表符号中“2”的含义正确的一组是( )
| 2He | Cl2 | Ca2+ | |
A | 质量数 | 中子数 | 质子数 | 电荷数 |
B | 质量数 | 质子数 | 原子数 | 电荷数 |
C | 质子数 | 中子数 | 原子数 | 电子数 |
D | 质量数 | 质子数 | 分子数 | 电荷数 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
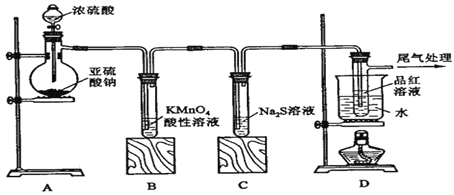
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是______________,其中发生反应的化学方程式为_______________________________________________________________;
(2)实验过程中,装置B、C中发生的现象分别是___________、___________,这些现象分别说明SO2具有的性质是__________和___________;装置B中发生反应的离子方程式为_______________________________________________________________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_____________________________;
(4)尾气可采用_____________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铝箔包裹4.6 g金属钠,用针扎一些小孔,放入水中,用排水取气法收集产生的气体,则收集到的气体为( )
A. O2和H2的混合气体 B. 0.1 mol H2 C. 大于0.1 mol H2 D. 小于0.1 mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com