
某混合气体X,可能由H2、CO、CO2和水蒸气中的一种或几种组成,现将混合气体通入灼热的CuO,完全反应后,固体 CuO质量减少1.6 g;再将反应后的混合气体全部导入足量的澄清石灰水中,生成白色沉淀10 g。根据以上信息,分析下列有关X的组成推断正确的是( )
A.X一定只由CO组成
B.X一定只由H2和CO2组成
C.X可能由0.1 g H2和4.4 g CO2组成
D.X可能由0.1 g H2、1.4 g CO、2.2 g CO2组成
【解析】 由反应后混合气体全部导入足量澄清石灰水中生成白色沉淀10 g可知,原混合气体中碳元素的物质的量n(C)=n(CaCO3)=10 g÷100 g·mol-1=0.1 mol,即混合气体中存在CO、CO2中的一种或两种,且这两种含碳混合气体的物质的量或一种含碳气体的物质的量为0.1 mol,由此判断A项和B项错;假设混合气体中含碳气体只有CO2,则一定含有氢气,由混合气体通入灼热的CuO后,CuO质量减少1.6 g可知,氢气的物质的量n(H2)=1.6 g÷16 g·mol-1=0.1 mol,即其质量为0.2 g,C项错;选项D中氢气和CO均能还原CuO,二者“夺取”的CuO中的O为0.1 g÷2 g·mol-1+1.4 g÷28 g·mol-1=0.1 mol,与CuO减少的1.6 g氧原子相符,同时n(C)=1.4 g÷28 g·mol-1+2.2 g÷44 g·mol-1=0.1 mol,D项正确。
【答案】 D


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
根据化学变化的实质是旧的化学键断裂、新的化学键形成这一理论,判断下列变化是化学变化的是
A.固体氯化钠溶于水 B.氯化铵受热分解生成氯化氢和氨气
C.冰经加热变成水蒸气 D.氯化氢溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实及其解释不正确的是 ( )。
A.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3
B.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气
C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO 2、H2O与Na2O2的反应是放热反应
2、H2O与Na2O2的反应是放热反应
D.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是________。
(2)混合 气体的平均摩尔质量是________。
气体的平均摩尔质量是________。
(3)CO2和CO的体积之比是________。
(4)CO的体积分数是________。
(5)CO2和CO的质量之比是________。
(6)CO的质量分数是________。
(7)混合气体中所含氧原子的物质的量是________。
(8)混合气体中所含碳原子的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
食品安全是社会关注的热点。市场上已检测出一些矿泉水中含有高浓度的致癌物“溴酸盐”,而这个“行业秘密”在人们的眼皮底下被隐藏了10多年。实验室中制备“溴酸盐”过程如下:

根据上述转化关系回答下列问题:
(1)反应①的化学方程式为______________________________。
(2)已知反应②是复分解反应,该反应的化学方程式为
___________________________________________。
(3)已知在酸性条件下溴酸盐可发生如下离子反应:
Ⅰ.2BrO +10Cl-+12H+===5Cl2↑+Br2+6H2O
+10Cl-+12H+===5Cl2↑+Br2+6H2O
Ⅱ.6BrO +5Cl-+6H+===5ClO
+5Cl-+6H+===5ClO +3Br2+3H2O
+3Br2+3H2O
Ⅲ.BrO +5Br-+6H+===3Br2+3H2O
+5Br-+6H+===3Br2+3H2O
①上述反应所涉及的粒子中,氧化性最强的是________。
②在KCl和KBr的酸性混合溶液中,加入过量的KBrO3,其氧化产物为________,还原产物为________。
③将12 mL 0.4 mol·L-1 KBrO3溶液和10 mL 0.6 mol·L-1 KCl溶液在稀H2SO4中混合,充分反应后,产物KClO3和Cl2的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列排列顺序正确的是 ( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4 ④失电子能力:Na>Mg>Al
⑤晶体的熔点:SiO2>NaCl>CCl4>SO2
A.②④⑤ B.①②④ C.②③⑤ D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
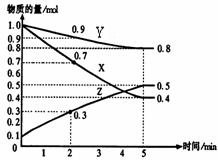
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如下图所示。
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)反应开始至2min时Z的平均反应速率为 ;
(3)下列关于化学反应速率与化学反应限度的叙述不正确的是 ( )
A.反应限度是一种平衡状态,此时反应已经停止
B.达到平衡状态时,正反应速率和逆反应速率相等
C.达到平衡状态时,反应物和生成物浓度都不再改变
D.化学反应速率理论是研究怎样在一定时间内快出产品
E. 化学平衡理论是研究怎样使用有限原料多出产品
(4)5min后曲线的含义 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
已知次氯酸能跟乙烯发生加成反应:CH2=CH2+HClO→CH2(OH)CH2Cl。又2R-CHO+O2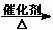 2R-COOH。以乙烯为原料制取聚氯乙烯(PVC)等产品的转化关系如图所示。
2R-COOH。以乙烯为原料制取聚氯乙烯(PVC)等产品的转化关系如图所示。
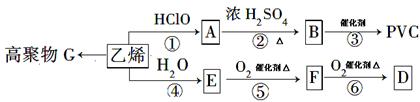
试回答下列问题:
(1)写出有机物B和G的结构简式:B____________,G_________;
(2)⑥的反应类型是________________;
(3)写出D的一种同分异构体的结构简式_______________________;
(4)写出反应⑤的化学方程式__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com