
食品安全是社会关注的热点。市场上已检测出一些矿泉水中含有高浓度的致癌物“溴酸盐”,而这个“行业秘密”在人们的眼皮底下被隐藏了10多年。实验室中制备“溴酸盐”过程如下:

根据上述转化关系回答下列问题:
(1)反应①的化学方程式为______________________________。
(2)已知反应②是复分解反应,该反应的化学方程式为
___________________________________________。
(3)已知在酸性条件下溴酸盐可发生如下离子反应:
Ⅰ.2BrO +10Cl-+12H+===5Cl2↑+Br2+6H2O
+10Cl-+12H+===5Cl2↑+Br2+6H2O
Ⅱ.6BrO +5Cl-+6H+===5ClO
+5Cl-+6H+===5ClO +3Br2+3H2O
+3Br2+3H2O
Ⅲ.BrO +5Br-+6H+===3Br2+3H2O
+5Br-+6H+===3Br2+3H2O
①上述反应所涉及的粒子中,氧化性最强的是________。
②在KCl和KBr的酸性混合溶液中,加入过量的KBrO3,其氧化产物为________,还原产物为________。
③将12 mL 0.4 mol·L-1 KBrO3溶液和10 mL 0.6 mol·L-1 KCl溶液在稀H2SO4中混合,充分反应后,产物KClO3和Cl2的物质的量之比为________。
【解析】 分析实验过程,由于反应②中只加入KCl,不会发生氧化还原反应,反推知反应①中必生成BrO ,由此得反应①中的化学方程式为6MgO+Br2+5Cl2===Mg(BrO3)2+5MgCl2,第一次过滤掉的滤渣是MgO。经过反应②又过滤,那原因是什么呢?考虑到加入KCl发生的是复分解反应,反应发生的原因显然是利用MgCl2溶解度小的特点,反应的化学方程式为Mg(BrO3)2+2KCl===MgCl2↓+2KBrO3,第二次过滤掉的滤渣是MgCl2,然后进行系列实验操作即可得KBrO3晶体。(3)在三个反应中BrO
,由此得反应①中的化学方程式为6MgO+Br2+5Cl2===Mg(BrO3)2+5MgCl2,第一次过滤掉的滤渣是MgO。经过反应②又过滤,那原因是什么呢?考虑到加入KCl发生的是复分解反应,反应发生的原因显然是利用MgCl2溶解度小的特点,反应的化学方程式为Mg(BrO3)2+2KCl===MgCl2↓+2KBrO3,第二次过滤掉的滤渣是MgCl2,然后进行系列实验操作即可得KBrO3晶体。(3)在三个反应中BrO 均作氧化剂,所以氧化性其最强。对比反应Ⅰ和Ⅱ,可知KBrO3过量时,Cl-被氧化成ClO
均作氧化剂,所以氧化性其最强。对比反应Ⅰ和Ⅱ,可知KBrO3过量时,Cl-被氧化成ClO ,还原产物为Br2,反应Ⅲ中Br2既是氧化产物也是还原产物。③由题可知KBrO3的物质的量为4.8×10-3 mol,KCl的物质的量为6×10-3 mol,两者物质的量之比为4∶5。设参加反应Ⅰ的KBrO3的物质的量为x,则参加反应Ⅱ的KBrO3的物质的量为
,还原产物为Br2,反应Ⅲ中Br2既是氧化产物也是还原产物。③由题可知KBrO3的物质的量为4.8×10-3 mol,KCl的物质的量为6×10-3 mol,两者物质的量之比为4∶5。设参加反应Ⅰ的KBrO3的物质的量为x,则参加反应Ⅱ的KBrO3的物质的量为
(4-x),由Cl-守恒得:5x+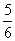 (4-x)=5,得x=
(4-x)=5,得x=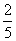 ,反应Ⅰ生成的氯气为1,反应Ⅱ生成的KClO3为3。
,反应Ⅰ生成的氯气为1,反应Ⅱ生成的KClO3为3。
【答案】 (1)6MgO+Br2+5Cl2===Mg(BrO3)2+5MgCl2
(2)Mg(BrO3)2+2KCl===MgCl2↓+2KBrO3
(3)①BrO ②KClO3、Br2 Br2 ③3∶1
②KClO3、Br2 Br2 ③3∶1


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
右图是第三周期元素的最高价氧化物的水化物某相同浓度稀溶液的pH与原子半径的关系示意图,则下列说法正确的是
A.原子序数:X>Z>W
B.气态氢化物的稳定性:N>R
C.Y和W形成共价化合物
D.X和Z两者最高价氧化物对应的水化物能相互反 应

查看答案和解析>>
科目:高中化学 来源: 题型:
现有25 mL 2 mol·L-1 Na2CO3和75 mL 1 mol·L-1的稀盐酸:①将Na2CO3溶液缓缓滴到稀盐酸中 ②将稀盐酸缓缓滴到Na2CO3溶液中,在标准状况下产生气体的体积情况是 ( )。
A.均为0.84 L B.均为0.56 L
C.①>② D.②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是( )
A.用熟石灰可处理酸性废水
B.用丁达尔效应可区分溶液和胶体
C.漂白粉能用来杀菌消毒,属于纯净物
D.明矾净水是因为Al3+水解生成Al(OH)3胶体,吸附水中悬浮物
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合气体X,可能由H2、CO、CO2和水蒸气中的一种或几种组成,现将混合气体通入灼热的CuO,完全反应后,固体 CuO质量减少1.6 g;再将反应后的混合气体全部导入足量的澄清石灰水中,生成白色沉淀10 g。根据以上信息,分析下列有关X的组成推断正确的是( )
A.X一定只由CO组成
B.X一定只由H2和CO2组成
C.X可能由0.1 g H2和4.4 g CO2组成
D.X可能由0.1 g H2、1.4 g CO、2.2 g CO2组成
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化属于吸热反应的是 ( )
①碳与二氧化碳化合 ②生石灰与水反应生成熟石灰 ③Zn与稀硫酸反应
④氯酸钾分解制氧气 ⑤Ba(OH)2.8H2O与NH4Cl反应 ⑥甲烷与氧气的燃烧
A.①④ B.②③ C.①④⑤ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质,化学键类型相同、晶体类型相同且熔化时破坏作用力类型也相同的 ( )
A.HCl KCl B.CO2 SiO2 C.NH4Cl CCl4 D.NaOH Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为
A.1∶2∶3 B.3∶2∶1 C.6∶3∶1 D.6∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X的原子最外层电子数是其内层的3倍。元素Y基态原子的3p轨道上有4个电子。元素Z位于第四周期,IIB族。
(1)Y与X可形成YX2
①YX2分子是 (填“极性”或“非极性”)分子。
②写出与YX2互为等电子体的分子的化学式: 。
③Y的一种单质,能溶于CS2,熔点112.8℃,沸点444.6℃。则其晶体类型为 。
(2)在X的氢化物(H2X)分子中,X原子轨道的杂化类型是 。
 (3)Z与Y所形成化合物晶体的晶胞如右图所示。
(3)Z与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,Z离子的数目为 。
②该化合物的化学式为 。
③1个Y周围距离最近且相等的Z有 个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com