
下列各组物质,化学键类型相同、晶体类型相同且熔化时破坏作用力类型也相同的 ( )
A.HCl KCl B.CO2 SiO2 C.NH4Cl CCl4 D.NaOH Na2O2
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.在NH4+和[Cu(NH3)4]2+中都存在配位键
B.C2H5OH与C2H5Br相比,前者的沸点远高于后者,其原因是前者的分子间存在氢键
C.同周期ⅠA族元素和 ⅦA族元素之间只能形成离子化合物
D.由两种非金属元素组成的化合物分子中只可能有极性键,不会有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是________。
(2)混合 气体的平均摩尔质量是________。
气体的平均摩尔质量是________。
(3)CO2和CO的体积之比是________。
(4)CO的体积分数是________。
(5)CO2和CO的质量之比是________。
(6)CO的质量分数是________。
(7)混合气体中所含氧原子的物质的量是________。
(8)混合气体中所含碳原子的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
食品安全是社会关注的热点。市场上已检测出一些矿泉水中含有高浓度的致癌物“溴酸盐”,而这个“行业秘密”在人们的眼皮底下被隐藏了10多年。实验室中制备“溴酸盐”过程如下:

根据上述转化关系回答下列问题:
(1)反应①的化学方程式为______________________________。
(2)已知反应②是复分解反应,该反应的化学方程式为
___________________________________________。
(3)已知在酸性条件下溴酸盐可发生如下离子反应:
Ⅰ.2BrO +10Cl-+12H+===5Cl2↑+Br2+6H2O
+10Cl-+12H+===5Cl2↑+Br2+6H2O
Ⅱ.6BrO +5Cl-+6H+===5ClO
+5Cl-+6H+===5ClO +3Br2+3H2O
+3Br2+3H2O
Ⅲ.BrO +5Br-+6H+===3Br2+3H2O
+5Br-+6H+===3Br2+3H2O
①上述反应所涉及的粒子中,氧化性最强的是________。
②在KCl和KBr的酸性混合溶液中,加入过量的KBrO3,其氧化产物为________,还原产物为________。
③将12 mL 0.4 mol·L-1 KBrO3溶液和10 mL 0.6 mol·L-1 KCl溶液在稀H2SO4中混合,充分反应后,产物KClO3和Cl2的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列排列顺序正确的是 ( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4 ④失电子能力:Na>Mg>Al
⑤晶体的熔点:SiO2>NaCl>CCl4>SO2
A.②④⑤ B.①②④ C.②③⑤ D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的离子aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则下列叙述正确的是 ( )
A.原子半径A>B>D>C B.原子序数 d > c > b > a
C.离子半径C>D>B>A D.单质的还原性A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
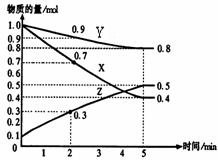
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如下图所示。
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)反应开始至2min时Z的平均反应速率为 ;
(3)下列关于化学反应速率与化学反应限度的叙述不正确的是 ( )
A.反应限度是一种平衡状态,此时反应已经停止
B.达到平衡状态时,正反应速率和逆反应速率相等
C.达到平衡状态时,反应物和生成物浓度都不再改变
D.化学反应速率理论是研究怎样在一定时间内快出产品
E. 化学平衡理论是研究怎样使用有限原料多出产品
(4)5min后曲线的含义 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,充分燃烧一定量的丁烷放出热量161.9 kJ,经测定完全吸收生成的CO2需消耗5 mol·L-1的KOH溶液100 mL,恰好生成正盐,则此条件下热化学方程式:
C4H10(g)+13/2O2(g)===4CO2(g)+5H2O(g)的ΔH为
A.+2 590.4 kJ·mol-1 B.-2 590.4 kJ·mol-1
C.+1 295.2 kJ·mol-1 D.-1 295.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下:
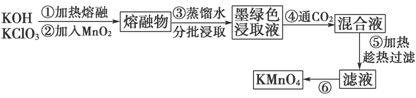
(1)第①步中采用铁坩埚而不用瓷坩埚的原因是(用化学方程式表示)_______________________________________________________________。
(2) KOH、KClO3和MnO2共熔反应生成墨绿色K2MnO4的化学方程式为________________________________________________________________。
(3)第④步通入CO2,可以使MnO 发生反应,生成MnO
发生反应,生成MnO 和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为____________________(精确到0.1%)。
和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为____________________(精确到0.1%)。
(4)第⑤步趁热过滤的目的是________________________________。
(5)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、___________、洗涤、干燥。干燥过程中,温度不宜过高,因为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com