
一定条件下,充分燃烧一定量的丁烷放出热量161.9 kJ,经测定完全吸收生成的CO2需消耗5 mol·L-1的KOH溶液100 mL,恰好生成正盐,则此条件下热化学方程式:
C4H10(g)+13/2O2(g)===4CO2(g)+5H2O(g)的ΔH为
A.+2 590.4 kJ·mol-1 B.-2 590.4 kJ·mol-1
C.+1 295.2 kJ·mol-1 D.-1 295.2 kJ·mol-1
科目:高中化学 来源: 题型:
现有25 mL 2 mol·L-1 Na2CO3和75 mL 1 mol·L-1的稀盐酸:①将Na2CO3溶液缓缓滴到稀盐酸中 ②将稀盐酸缓缓滴到Na2CO3溶液中,在标准状况下产生气体的体积情况是 ( )。
A.均为0.84 L B.均为0.56 L
C.①>② D.②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质,化学键类型相同、晶体类型相同且熔化时破坏作用力类型也相同的 ( )
A.HCl KCl B.CO2 SiO2 C.NH4Cl CCl4 D.NaOH Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为
A.1∶2∶3 B.3∶2∶1 C.6∶3∶1 D.6∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是
A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量

查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+ K+ Cu2+ |
| 阴离子 | SO42- OH- |
如图所示的装置中,甲、乙、丙三个烧杯分别盛放足量的A溶液、足量的B溶液、足量的c溶液,电极均为石墨电极。

接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电解时间t的关系如图。据此回答下列问题:
(1)M为电源的 极;电极b上发生的电极反应为 。
(2)计算电极e上生成的气体在标准状况下的体积 。
(3)写出乙烧杯中发生电解反应的总反应式 。
(4)如果电解过程中乙烧杯溶液中的金属离子全部析出,此时电解反应能否继续进行,为什么 。
(5)此时要使丙中溶液恢复到原来的状态,操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列由相关实验现象所推出的结论正确的是
A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42-
C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X的原子最外层电子数是其内层的3倍。元素Y基态原子的3p轨道上有4个电子。元素Z位于第四周期,IIB族。
(1)Y与X可形成YX2
①YX2分子是 (填“极性”或“非极性”)分子。
②写出与YX2互为等电子体的分子的化学式: 。
③Y的一种单质,能溶于CS2,熔点112.8℃,沸点444.6℃。则其晶体类型为 。
(2)在X的氢化物(H2X)分子中,X原子轨道的杂化类型是 。
 (3)Z与Y所形成化合物晶体的晶胞如右图所示。
(3)Z与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,Z离子的数目为 。
②该化合物的化学式为 。
③1个Y周围距离最近且相等的Z有 个。
查看答案和解析>>
科目:高中化学 来源: 题型:
能源的开发利用与人类社会的可持续发展息息相关。
Ⅰ.已知:Fe2O3(s)+3C(s)===2Fe(s)+3CO(g)
ΔH1=a kJ·mol-1
CO(g)+ O2(g)===CO2(g) ΔH2=b kJ·mol-1
O2(g)===CO2(g) ΔH2=b kJ·mol-1
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH3=c kJ·mol-1
则C的燃烧热ΔH=________kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是________(填序号)。
A.C(s)+CO2(g)===2CO(g)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
C.2H2O(l)===2H2(g)+O2(g)
D.2CO(g)+O2(g)===2CO2(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:_____________________________________。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中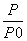 与时间t的关系如图所示。
与时间t的关系如图所示。

请回答下列问题:
①反应达平衡的标志是__________________________(填字母代号,下同)。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②0~2 min内,以c(N2)变化表示的平均反应速率为________________。
③欲提高N2的转化率,可采取的措施有_____________________________。
A.向体系中按体积比1∶1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入氦气使压强增大
E.加入一定量的N2
(3)25℃时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(CO )=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________mol·L-1。
)=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com