
已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是
A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量

科目:高中化学 来源: 题型:
下列事实及其解释不正确的是 ( )。
A.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3
B.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气
C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO 2、H2O与Na2O2的反应是放热反应
2、H2O与Na2O2的反应是放热反应
D.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列排列顺序正确的是 ( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4 ④失电子能力:Na>Mg>Al
⑤晶体的熔点:SiO2>NaCl>CCl4>SO2
A.②④⑤ B.①②④ C.②③⑤ D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
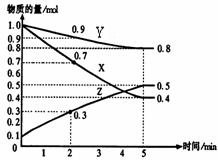
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如下图所示。
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)反应开始至2min时Z的平均反应速率为 ;
(3)下列关于化学反应速率与化学反应限度的叙述不正确的是 ( )
A.反应限度是一种平衡状态,此时反应已经停止
B.达到平衡状态时,正反应速率和逆反应速率相等
C.达到平衡状态时,反应物和生成物浓度都不再改变
D.化学反应速率理论是研究怎样在一定时间内快出产品
E. 化学平衡理论是研究怎样使用有限原料多出产品
(4)5min后曲线的含义 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃、101 kPa 下:①2Na(s)+ O2(g)===Na2O(s) ΔH1=-414 kJ/mol
O2(g)===Na2O(s) ΔH1=-414 kJ/mol
②2Na(s)+O2(g)===Na2O2(s) ΔH2=-511 kJ/mol。下列说法正确的是
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25 ℃、101 kPa 下,Na2O2(s)+2Na(s)===2Na2O(s) ΔH=-317 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,充分燃烧一定量的丁烷放出热量161.9 kJ,经测定完全吸收生成的CO2需消耗5 mol·L-1的KOH溶液100 mL,恰好生成正盐,则此条件下热化学方程式:
C4H10(g)+13/2O2(g)===4CO2(g)+5H2O(g)的ΔH为
A.+2 590.4 kJ·mol-1 B.-2 590.4 kJ·mol-1
C.+1 295.2 kJ·mol-1 D.-1 295.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知次氯酸能跟乙烯发生加成反应:CH2=CH2+HClO→CH2(OH)CH2Cl。又2R-CHO+O2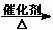 2R-COOH。以乙烯为原料制取聚氯乙烯(PVC)等产品的转化关系如图所示。
2R-COOH。以乙烯为原料制取聚氯乙烯(PVC)等产品的转化关系如图所示。
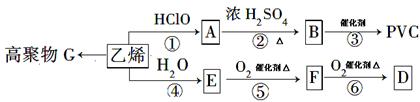
试回答下列问题:
(1)写出有机物B和G的结构简式:B____________,G_________;
(2)⑥的反应类型是________________;
(3)写出D的一种同分异构体的结构简式_______________________;
(4)写出反应⑤的化学方程式__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同的温度下,体积均为0.25 L的两恒容密闭容器中发生可逆反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如表所示,下列叙述错误的是( )
| 起始时各物质的物质 的量(mol) | 达到平衡时能量变化 | |||
| 容器编号 | N2 | H2 | NH3 | |
| ① | 1 | 3 | 0 | 放出23.15 kJ能量 |
| ② | 0.9 | 2.7 | 0.2 | 放出Q kJ能量 |
A.容器①、②中反应的化学平衡常数相等
B.平衡时,两容器中氨气的体积分数均为14.3%
C.反应②达到平衡时,放出的热量Q=23.15 kJ
D.若①的体积为0.5 L,则达到平衡时放出的热量小于23.15 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com