
近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下:
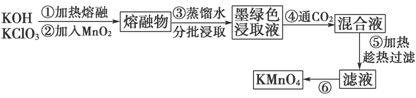
(1)第①步中采用铁坩埚而不用瓷坩埚的原因是(用化学方程式表示)_______________________________________________________________。
(2) KOH、KClO3和MnO2共熔反应生成墨绿色K2MnO4的化学方程式为________________________________________________________________。
(3)第④步通入CO2,可以使MnO 发生反应,生成MnO
发生反应,生成MnO 和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为____________________(精确到0.1%)。
和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为____________________(精确到0.1%)。
(4)第⑤步趁热过滤的目的是________________________________。
(5)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、___________、洗涤、干燥。干燥过程中,温度不宜过高,因为_________________。
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
下列各组物质,化学键类型相同、晶体类型相同且熔化时破坏作用力类型也相同的 ( )
A.HCl KCl B.CO2 SiO2 C.NH4Cl CCl4 D.NaOH Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列由相关实验现象所推出的结论正确的是
A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42-
C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X的原子最外层电子数是其内层的3倍。元素Y基态原子的3p轨道上有4个电子。元素Z位于第四周期,IIB族。
(1)Y与X可形成YX2
①YX2分子是 (填“极性”或“非极性”)分子。
②写出与YX2互为等电子体的分子的化学式: 。
③Y的一种单质,能溶于CS2,熔点112.8℃,沸点444.6℃。则其晶体类型为 。
(2)在X的氢化物(H2X)分子中,X原子轨道的杂化类型是 。
 (3)Z与Y所形成化合物晶体的晶胞如右图所示。
(3)Z与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,Z离子的数目为 。
②该化合物的化学式为 。
③1个Y周围距离最近且相等的Z有 个。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.除去Cl2中少量的HCl,可将混合气体通过盛有饱和NaCl溶液的洗气瓶
B.向久置于空气的FeCl2溶液中滴入KSCN溶液,会产生Fe(SCN)3血红色沉淀
C.向某溶液中滴入稀盐酸产生使澄清石灰水变浑浊的气体,该溶液一定含有CO
D.实验室可采用分液法直接分离乙酸乙酯和乙醇的混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室中,下列除去杂质的方法不正确的是( )
A.溴苯中混有溴,加入碳酸钠溶液,振荡,然后分液
B.乙烷中混有乙烯,通入氢气,在一定条件下反应,使乙烯转化为乙烷
C.硝基苯中混有浓HNO3和浓H2SO4,将其倒入NaOH溶液中,静置,分液
D.乙烯中混有SO2和CO2,将其通入NaOH溶液中洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其结论都正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
能源的开发利用与人类社会的可持续发展息息相关。
Ⅰ.已知:Fe2O3(s)+3C(s)===2Fe(s)+3CO(g)
ΔH1=a kJ·mol-1
CO(g)+ O2(g)===CO2(g) ΔH2=b kJ·mol-1
O2(g)===CO2(g) ΔH2=b kJ·mol-1
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH3=c kJ·mol-1
则C的燃烧热ΔH=________kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是________(填序号)。
A.C(s)+CO2(g)===2CO(g)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
C.2H2O(l)===2H2(g)+O2(g)
D.2CO(g)+O2(g)===2CO2(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:_____________________________________。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中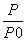 与时间t的关系如图所示。
与时间t的关系如图所示。

请回答下列问题:
①反应达平衡的标志是__________________________(填字母代号,下同)。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②0~2 min内,以c(N2)变化表示的平均反应速率为________________。
③欲提高N2的转化率,可采取的措施有_____________________________。
A.向体系中按体积比1∶1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入氦气使压强增大
E.加入一定量的N2
(3)25℃时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(CO )=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________mol·L-1。
)=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com