
下列化学实验事实及其结论都正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:
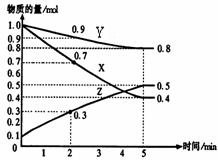
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如下图所示。
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)反应开始至2min时Z的平均反应速率为 ;
(3)下列关于化学反应速率与化学反应限度的叙述不正确的是 ( )
A.反应限度是一种平衡状态,此时反应已经停止
B.达到平衡状态时,正反应速率和逆反应速率相等
C.达到平衡状态时,反应物和生成物浓度都不再改变
D.化学反应速率理论是研究怎样在一定时间内快出产品
E. 化学平衡理论是研究怎样使用有限原料多出产品
(4)5min后曲线的含义 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
已知次氯酸能跟乙烯发生加成反应:CH2=CH2+HClO→CH2(OH)CH2Cl。又2R-CHO+O2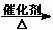 2R-COOH。以乙烯为原料制取聚氯乙烯(PVC)等产品的转化关系如图所示。
2R-COOH。以乙烯为原料制取聚氯乙烯(PVC)等产品的转化关系如图所示。
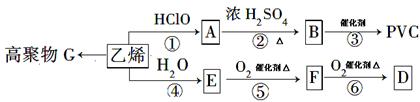
试回答下列问题:
(1)写出有机物B和G的结构简式:B____________,G_________;
(2)⑥的反应类型是________________;
(3)写出D的一种同分异构体的结构简式_______________________;
(4)写出反应⑤的化学方程式__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下:
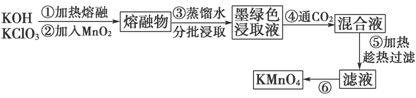
(1)第①步中采用铁坩埚而不用瓷坩埚的原因是(用化学方程式表示)_______________________________________________________________。
(2) KOH、KClO3和MnO2共熔反应生成墨绿色K2MnO4的化学方程式为________________________________________________________________。
(3)第④步通入CO2,可以使MnO 发生反应,生成MnO
发生反应,生成MnO 和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为____________________(精确到0.1%)。
和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为____________________(精确到0.1%)。
(4)第⑤步趁热过滤的目的是________________________________。
(5)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、___________、洗涤、干燥。干燥过程中,温度不宜过高,因为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学物质在实际生产生活和科技等方面的应用不正确的是( )
A.测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热
B.石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料
C.因为氨易液化,液氨在汽化时会吸收大量的热量,所以液氨可作制冷剂
D.硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组设计用如图装置验证二氧化硫的化学性质。

(1)能说明二氧化硫具有氧化性的实验现象为_________________________。
(2)为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为____________________________________________。
(3)当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同的温度下,体积均为0.25 L的两恒容密闭容器中发生可逆反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如表所示,下列叙述错误的是( )
| 起始时各物质的物质 的量(mol) | 达到平衡时能量变化 | |||
| 容器编号 | N2 | H2 | NH3 | |
| ① | 1 | 3 | 0 | 放出23.15 kJ能量 |
| ② | 0.9 | 2.7 | 0.2 | 放出Q kJ能量 |
A.容器①、②中反应的化学平衡常数相等
B.平衡时,两容器中氨气的体积分数均为14.3%
C.反应②达到平衡时,放出的热量Q=23.15 kJ
D.若①的体积为0.5 L,则达到平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组微粒,半径大小比较中错误的是 ( )
A.K >Na >Li B.Na+>Mg2+>Al3+ C.Cl—>F—>F D.Mg2+>Na+>F—
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图,A为直流电源,c、d均为石墨电极,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为________极;
(2)滤纸B上发生的总化学方程式为___________________;
(3)欲在电镀槽中实现铁上镀锌,闭合K键,使c、d两点短路,则电极e上发生的反应为 ,电极f上发生的反应为______________________________,槽中放的电镀液可以是 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com