
【题目】有下列几组物质,请将序号填入下列空格内:
A.CH2=CH-COOH和油酸(C17H33COOH)
B.12C60和石墨
C.乙醇和乙二醇
D.
E、35Cl和37Cl
①互为同分异构体的是 ;
②互为同系物的是 ;
③不是同系物,不是同分异构体,也不是同素异形体,但可看成是同一类物质的是
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是 ( )
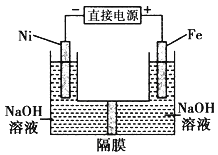
A.铁是阳极,电极反应为 Fe-6e一+4H2O=FeO42-+ 8H+
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜, 则电解结束后左侧溶液中含有FeO42-
D.电解时阳极区pH 降低、阴极区 pH升高,撤去隔膜混合后,与原溶液比较 pH升高(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn;③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:(填写时用对应元素符号或物质的化学式)
(1)五种元素原子中基态时未成对电子数最多的是 。
(2)基态原子Y的轨道表示式是:![]()
(3)基态原子Z的电子排布式是 。向Z的硫酸盐溶液中加入过量氨水时反应的离子方程式是 ,所得产物中含Z元素在内的离子的结构示意图是:(不考虑空间构型,如有配位键,请标出)
(4)Q、R、X的电负性由小到大的顺序是 。
(5)Q、X和Y的氢化物稳定性由小到大的顺序为 。
(6)在一定条件下,原子的核外电子从激发态跃迁到基态产生的光谱属于 光谱(填“吸收”或“发射”),该光谱可用于 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计如下流程,从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO42)中提取铬.

有关数据如表:
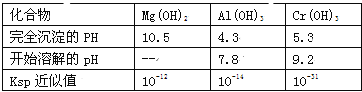
回答下列问题:
(1)步骤①所得滤液可用于制取MgSO47H2O,酸性工业废液中加入适量氧化铝的作用是____。
(2)若酸性废液中c(Mg2+)=0.1mol/L,为达到步骤①的实验目的,则废液的pH应保持在_______范围(保留小数点后l位)。当溶液Ph=5时,c(Cr3+)=__________
(3)步骤②中生成NaCrO2 的离子方程式为_____________。
(4)步骤④中反应的离子方程式为________________。
(5)步骤⑤在空气中充分灼烧的目的是__________________,可选用的装置是________。(填序号)

(6)步骤⑦发生的化学反应方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的合适组号填写在空格上。
① 金刚石与石墨; ② 氧气(O2)与臭氧(O3);
③ 16O、17O和18O; ④ CH4和CH3CH2CH3;
⑤ 乙烯和乙烷;
⑥![]() 和
和![]() ; ⑦
; ⑦![]() 和
和 ;
;
(1)同位素 ,(2)同素异形体 ,
(3)同系物 ,(4)同分异构体 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳豆是一种减肥食品,从其中分离出一种由C、H、O三种元素组成的有机物A,为确定其结构现进行如下实验:
①相同条件下,测得A的蒸气密度是H2密度的60倍
②6gA在一定条件下完全燃烧,生成3.36L二氧化碳(标况)和1.8g水
③1mol物质A发生酯化反应,转化完全时消耗乙醇92g,等量的A能与足量的金属钠反应放出33.6L氢气(标况)试计算确定: (写过程)
(1)A的分子式____________________
(2)A的结构简式________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
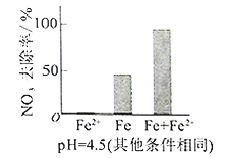
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中能发生化学反应,且甲组为取代反应、乙组为加成反应的是( )
甲 | 乙 | |
A | 苯与溴水 | 乙烯与水制乙醇(催化剂) |
B | 油脂水解 | 苯与氢气(催化剂、加热) |
C | 甲烷与氯气(在光亮处) | 乙酸和乙醇的酯化反应(催化剂、加热) |
D | 乙烯与溴的四氯化碳溶液 | 乙醇与钠反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届厦门一模】磷化氢( PH3)是一种剧毒气体,是最常用的高效熏蒸杀虫剂,也是一种电子工业原料。
(1)在密闭粮仓放置的磷化铝(AlP)片剂,遇水蒸气放出PH3气体,该反应的化学方程式为 。
(2)利用反应PH3+3HgCl2= P(HgCl)3 +3HCl,可准确测定微量的PH3。
①HgCl2溶液几乎不导电,说明HgCl2属于________________(填“共价”或“离子”)化合物。
②通过测定溶液____________变化,可测定一定体积空气中PH3的浓度。
(3)PH3的一种工业制法涉及的物质转化关系如下图所示: 
①亚磷酸属于________________元酸。
②当反应I生成的n(NaH2PO2):n(Na2HPO3) =3:1时,参加反应的n(P4):n(NaOH)= 。
(4)一种用于处理PH3废气的吸收剂成分为次氯酸钙80%、锯木屑(疏松剂)15%、活性炭2.5%、滑石粉(防结块)2.5%。
①次氯酸钙将PH3氧化为H3PO4的化学方程式为________________。
②空气中的水蒸气可加快PH3的氧化过程,其原因可能是____________。
(5)从(4)中的吸收残留物中回收磷酸氢钙(CaHPO4)的方法如下:
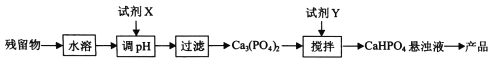
①试剂x为 (填化学式)。
②已知25℃时,H3PO4的Kal=7.5×10-3、Ka2=6.3×10-8、Ka3 =4.4×10-13。加入Y时,应控制悬浊液pH 7(填“>”、“=”或“<”),通过计算说明理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com