
【题目】某化学兴趣小组设计如下流程,从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO42)中提取铬.

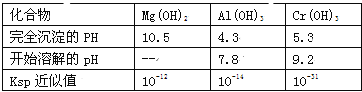
有关数据如表:
回答下列问题:
(1)步骤①所得滤液可用于制取MgSO47H2O,酸性工业废液中加入适量氧化铝的作用是____。
(2)若酸性废液中c(Mg2+)=0.1mol/L,为达到步骤①的实验目的,则废液的pH应保持在_______范围(保留小数点后l位)。当溶液Ph=5时,c(Cr3+)=__________
(3)步骤②中生成NaCrO2 的离子方程式为_____________。
(4)步骤④中反应的离子方程式为________________。
(5)步骤⑤在空气中充分灼烧的目的是__________________,可选用的装置是________。(填序号)

(6)步骤⑦发生的化学反应方程式为____________________________。
【答案】
(1)调节溶液的pH;
(2)5.3<pH<7.8,10-4mol/L;
(3)Cr(OH)3+OH-=CrO2-+2H2O;
(4)7H2O+4CrO42-+6S=4Cr(OH)3↓+3S2O32-+2OH-;
(5)使Cr(OH)3完全转化为Cr2O3, D;
(6)2Al+ Cr2 O3![]() Al2O3+2Cr
Al2O3+2Cr
【解析】
试题分析:(1)从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO42)中提取铬,步骤①所得滤液可用于制取MgSO47H2O,向滤液中加入氧化铝的作用是调节溶液的pH,得到滤渣为氢氧化铝和氢氧化铬,滤液中主要是硫酸镁溶液,滤渣A中加入过量的氢氧化钠得到CrO2-、AlO2-溶液,加入氧气将CrO2-氧化为CrO4-,再加入硫磺,过滤得到氢氧化铬。(1)酸性工业废水中加入适量的氧化铝的作用是调节溶液的pH,得到氢氧化铝和氢氧化铬,答案为:调节溶液的pH;(2)步骤①的实验目的是得到氢氧化铝和氢氧化铬,根据表中的数据可知废液的pH应保持在5.3~7.8,当溶液的pH为5时,c(OH-)=10-9,经计算得c(Cr3+)=10-4mol/L,答案为:5.3<pH<7.8,10-4mol/L;(3)步骤②中生成NaCrO2 的离子方程式为Cr(OH)3+OH-=CrO2-+2H2O,答案为:Cr(OH)3+OH-=CrO2-+2H2O;(4)步骤④加硫磺得到铬酸根,反应的离子方程式为:7H2O+4CrO42-+6S=4Cr(OH)3↓+3S2O32-+2OH-,答案为:7H2O+4CrO42-+6S=4Cr(OH)3↓+3S2O32-+2OH-;(5)步骤⑤在空气中充分灼烧的目的是为将氢氧化铬分解得到氧化铬,应该用到坩埚,答案为:使Cr(OH)3完全转化为Cr2O3,D;(6)步骤⑦是Al将三氧化二铬中的铬置换出来,即铝热反应,答案为:2Al+ Cr2 O3![]() Al2O3+2Cr.
Al2O3+2Cr.


科目:高中化学 来源: 题型:
【题目】中学实验室用如图所示装置制取少量溴苯。请填写下列空白。

(1)在烧瓶a中装的试剂是苯、溴和铁屑。导管b的作用有两个:一是导气,二是兼起_____的作用。
(2)反应过程中在导管c的下口附近可以观察到白雾出现,这是由于反应生成的_ _遇水蒸气而形成的。
(3)反应完毕后,向锥形瓶d中滴入AgNO3溶液,有__________生成。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有__________色不溶于水的液体。这是溶解了__________的粗溴苯。
(5)写出烧瓶a中发生反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱。
(1)写出电极反应式,负极:________________________。正极:________________________。
(2)请在下面方框中画出原电池的装置图,标出外电路电子流向(注明电极材料、电解质溶液,连成闭合回路)。

(3)Cu2+、Fe3+的氧化性由强到弱的顺序为:___________。
(4)该装置反应一段时间后,当溶液的质量增加3.2 g时,通过导线的电子的物质的量是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解草酯是一种除草安全剂,可以通过以下方法合成:

(1)化合物D中的含氧官能团的名称为 和 。
(2)化合物B的结构简式为 ;由C→D的反应类型是 。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式 。
Ⅰ.能发生银镜反应Ⅱ.分子含有1个苯环,苯环上含有硝基 Ⅲ.分子中含有4种不同化学环境的氢
(4)已知:![]()
请写出以苯酚和丙醛为原料制备高分子化合物X(结构简式见图)的合成路线流程(无机试剂可任选)。合成路线流程图示例如下:

![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类对于晶体结构的持续探究揭开了晶体内部的奥秘,并合成了许许多多的新物质、新材料。回答下列问题:
(1)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
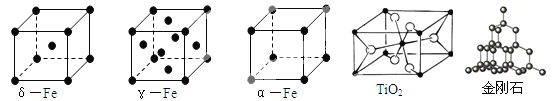
(2)TiO2的天然晶体中,最稳定的一种晶体结构如上图,白球表示: 原子。
(3)NaCl、CO2、SiO2三种晶体熔点由低到高的顺序是 。
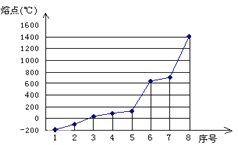
(4)第三周期八种元素按单质熔点由低到高的顺序排列如图所示,其中序号1和8分别代表的是 和 。
(5)已知:Cr3+可形成配位数为6的配合物。组成为CrCl3·6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3∶2∶1。则绿色配合物的化学式为 (选填代号)。
A.[CrCl(H2O)5]Cl2·H2O B.[CrCl2(H2O)4]Cl·2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3]·3H2O
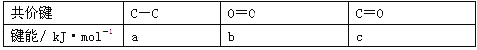
(6)根据下表所示键能,写出金刚石(结构如上图)完全燃烧时的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如下图。下列有关说法肯定错误的是
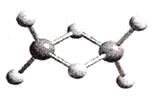
A. Al2H6在固态时所形成的晶体是分子晶体
B. 氢铝化合物可能成为未来的储氢材料和火箭燃料
C. Al2H6中含有离子键和极性共价键
D. Al2H6在空气中完全燃烧,产物为氧化铝和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A.CH2=CH-COOH和油酸(C17H33COOH)
B.12C60和石墨
C.乙醇和乙二醇
D.
E、35Cl和37Cl
①互为同分异构体的是 ;
②互为同系物的是 ;
③不是同系物,不是同分异构体,也不是同素异形体,但可看成是同一类物质的是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A常用于食品行业。已知9.0 g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2 g,经检验剩余气体为O2。

(1) A分子的质谱图如图所示,从图中可知其相对分子质量是___________,则A的分子式是___________;
(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是___________。
(3)A分子的核磁共振氢谱有4个吸收峰,峰面积之比是1:1:1:3,则A的结构简式是___________;
(4)写出两分子A生成六元环酯的化学方程式: ;
(5)请写出官能团与A相同的同分异构体的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O广泛用作颜料和化工生产的催化剂。
(1)用铜作阳极,钦片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,有关转化如图所示。

将得到的Cu2O溶于稀硫酸,发现有红色固体生成,该反应中氧化剂与还原剂的质量之比为___________。图中③④两步反应的总反应离子方程式为________________。
(2)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇:CO(g)+2H2(g)=CH3OH(g) △H=akJ·mol-1;按![]() 的投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,CO的平衡转化率与温度、压强的关系如图所示。
的投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,CO的平衡转化率与温度、压强的关系如图所示。

①图中压强pl、p2、p3由大到小的顺序是_________。
②a _________(填“>”或“<”) 0。
③起始时,c(H2)=0.20mol/L。c(CO)=0.10 mol/L,在p3及Tl℃下反应CO(g)+ 2H2(g)=CH3OH(g)达到平衡,该温度下反应的平衡常数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com