
����Ŀ����ѧʵ��������ͼ��ʾװ����ȡ�����屽������д���пհס�

��1������ƿa��װ���Լ��DZ��������м������b��������������һ�ǵ��������Ǽ���_____�����á�
��2����Ӧ�������ڵ���c���¿ڸ������Թ۲쵽�������֣��������ڷ�Ӧ���ɵ�_ _��ˮ�������γɵġ�
��3����Ӧ��Ϻ�����ƿd�е���AgNO3��Һ����__________���ɡ�
��4����Ӧ��Ϻ���ƿa�е�Һ�嵹��ʢ����ˮ���ձ�����Թ۲쵽�ձ��ײ���__________ɫ������ˮ��Һ�塣�����ܽ���__________�Ĵ��屽��
��5��д����ƿa�з�����Ӧ�Ļ�ѧ����ʽ��____________��
���𰸡�
��1������������
��2��HBr��
��3������ɫ����(��AgBr����) ��
��4���� �壻
��5�� ![]()
��������
�����������1���������ӷ�������b�������⣬�����������������ã����ԭ�������ʡ�
��2���������ȡ����Ӧ���������屽�⣬�������廯�⣬�廯����ˮ�����γɰ�����
��3���廯������ˮ������������Ӻ���������Ӧ���ɵ���ɫ�廯��������
��4���������屽������ˮ�����ܶȴ���ˮ�ģ��������²㣬�ӷ������������屽���������ձ��ײ��к�ɫ������ˮ��Һ�壬�����ܽ�����Ĵ��屽��
��5���ڴ����������£������ϵ���ԭ�ӱ���ԭ����ȡ���������屽��ͬʱ���廯�����ɣ���Ӧ����ʽΪ![]()


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣���ش��й�����

��1����������Ԫ�ط�����_______��_______��
��2����������õĽ���Ԫ����___________���γɻ�������������Ԫ����_________����дԪ�����ƣ���
��3���������γ��������������Ԫ����___________���ֱ�д����Ԫ�ص���������������������������ˮ���ﷴӦ�Ļ�ѧ����ʽ��__________________��__________________��
��4��֤��Ԫ���������ǽ�����ǿ������һ����ѧ����ʽ��ʾ��_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ϳ���ȼ�շ�ȷ���л�����ɣ����ַ������ڵ�¯����ʱ�ô���������������Ʒ�����ݲ��������ȷ���л������ɣ���ͼ������װ������ȼ�շ�ȷ���л������ʽ���õ�װ�á�
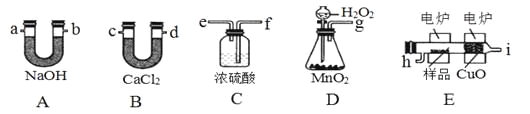
�ش��������⣺
��1��������������������������ѡ���װ�ø����ܵ�����˳����____��
��2��Cװ����Ũ�����������________��
��3����ȷ��ȡ7.2g��Ʒ��ֻ��C��H��O����Ԫ���е����ֻ����֣��������ȼ�պ�A����������22g��B����������10.8g������л����ʵ��ʽΪ____��
��4��Ҫȷ�����л���ķ���ʽ���� ��������������������Ҫ�ⶨ�������ݣ�����ȷ�������ʽ����һ�ȴ���ֻ��һ�֣�����ṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵĽṹ�������ʵ����ʡ���ش������漰���ʽṹ�����ʵ����⣺
��1���ڶ������У�Ԫ�صĵ�һ�����ܴ���B��N֮���Ԫ����_________�֡�
��2��ijԪ��λ�ڵ������ڢ��壬���̬ԭ�ӵ�δ�ɶԵ��������̬̼ԭ�ӵ�δ�ɶԵ�������ͬ�������̬ԭ�ӵļ۲�����Ų�ʽΪ_________________
��3����ϩͪ��CH2��C��O����һ����Ҫ���л��м��壬����CH3COOH��(C2H5O)3P��O�����¼�����H2O�õ�����ϩͪ������̼ԭ���ӻ����������_____________��1mol (C2H5O)3P��O�����к��еĦҼ���м�����Ŀ��Ϊ__________________��
��4����֪��̬NH3��H2O��HF��������ܺͽṹ���£�

����H2O��HF��NH3�е����ν��͵�ԭ��___________________��
��5��̼����Ľṹ����ʯ����(��ͼ��ʾ)����Ӳ�Ƚ����ڽ��ʯ�����н�ǿ����ĥ���ܡ�̼���辧���ṹ��ÿ��̼ԭ����Χ�����������Ĺ�ԭ����___________������̼ԭ�ӵȾ��������̼ԭ����__________������֪̼���辧���߳�Ϊa pm����̼������ܶ�Ϊ__________g��cm3��
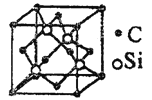
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�����������Դ���������⣬������������о���γ�����ú�����Դ��
���� �Ӻ�ˮ�п�����ȡʳ�Ρ�
�����Ӻ�ˮ����ȡþ����֪MgO��MgCl2���۵�ֱ�Ϊ2800����604�����Ӻ�ˮ����
ȡþ��������ķ����� ��
A����ˮ![]() Mg��OH��2
Mg��OH��2![]() Mg
Mg
B����ˮ![]() MgCl2��Һ��MgCl2����
MgCl2��Һ��MgCl2����![]() Mg
Mg
C����ˮ![]() Mg��OH��2
Mg��OH��2![]() MgO
MgO![]() Mg
Mg
D����ˮ![]() Mg��OH��2
Mg��OH��2![]() MgCl2��Һ��MgCl2����
MgCl2��Һ��MgCl2����![]() Mg
Mg
�����Ӻ�ˮ�����塣�乤ҵ�����У����������������շ�����������SO2���շ�����
����ȡ���ȡ�
��1�����������������շ���������ͨ�븻�������ӵĺ�ˮ�У����ÿ������崵����
�ô�����Һ���գ�����������ữ�����ɵõ��嵥�ʣ��÷����漰�ķ�Ӧ�У�
�� ��д�����ӷ���ʽ����
��3Br2+3CO32���TBrO3��+5Br��+3CO2����
��BrO3��+5Br��+6H+�T3Br2+3H2O
��2����������SO2���շ����÷�������ͬ��1����ֻ�ǽ��崵��������SO2�����յģ�
Ȼ�����������������õ����塣
д�������������Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015����812������Σ���ֿⱬը������������Ʋ����ش���ʧ���ݲ�Σ���ֿ��д��д������ơ��أ�����狀��軯��(NaCN)��NaCN���ھ綾���ʣ�������������������Ⱦ�����ͺ�ˮ����ش��������⣺
��1���ơ����Ż����п�����������______________��
A��ˮ B����ĭ����� C���ɷ������ D��ϸɳ����
��2��NH4NO3Ϊ��ը��ڲ�ͬ�¶������ȷֽ⣬�ɷ�����ͬ�Ļ�ѧ��Ӧ��
��110��ʱ��NH4NO3��NH3+HNO3
��185��200��ʱ��NH4NO3��N2O+2H2O
��230�� ����ʱ��ͬʱ�����⣺2NH4NO3��2N2+O2+4H2O
��400�� ����ʱ��������ը��4NH4NO3��3N2+2NO2+8H2O
������Ӧ������һ���ƻ���______________��(�������Ӽ����������ۼ����������Ӽ����ۼ���)
��3��NaCN �ĵ���ʽΪ______________��������˵��̼�뵪��Ԫ�طǽ��������ǿ������______________��
A�����ԣ�HNO2��H2CO3
B����ͬ������ˮ��Һ�� pH��NaHCO3��NaNO3
C��CH4��NH3���ȶ�
D��C ��H2�Ļ��ϱ�N2��H2�Ļ��ϸ�����
��4����ˮ�к���Ca2+��Mg2+��HCO3�� ���������ӡ��ö��Ե缫��⺣ˮʱ�����ײ���ˮ��������Ҫ�ɷ��� Mg(OH)2��CaCO3��д����⺣ˮ�����ӷ���ʽ______________������CaCO3�����ӷ���ʽ��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ���������й㷺��;������(Ni)�������缫���ŨNaOH��Һ�Ʊ���������Na2FeO4��װ����ͼ��ʾ�������ƶϺ������� ( )
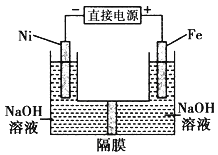
A�������������缫��ӦΪ Fe��6eһ+4H2O=FeO42��+ 8H+
B�����ʱ���ӵ���������Ϊ��������Ni�缫����Һ��Fe�缫������
C������ĤΪ�����ӽ���Ĥ�� ��������������Һ�к���FeO42-
D�����ʱ������pH ���͡������� pH���ߣ���ȥ��Ĥ��Ϻ���ԭ��Һ�Ƚ� pH����(������ǰ������仯���Բ���)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��ͬѧ��������ʵ�飬�Լ��黯ѧ��Ӧ�е������仯��
![]()
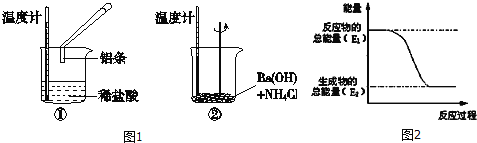
��ش��������⣺
��1��ʵ���з��֣���Ӧ����е��¶����ߣ����е��¶Ƚ��ͣ��ɴ��ж�����������ķ�Ӧ�� �ȷ�Ӧ��Ba��OH��28H2O��NH4Cl�ķ�Ӧ�� �ȷ�Ӧ����Ӧ���� ����١��ڡ����������仯����ͼ2��ʾ��
��2����������������Ӧ����A��NaOH+HCl=NaCl+H2O ��B��2FeCl3+Cu=2FeCl2+CuCl2
������������Ӧ����Ƴ�ԭ�������
��д�����ԭ������������缫��Ӧʽ �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������������̣������Թ�ҵ��Һ(��H+��Al3+��Mg2+��Cr3+��SO42)����ȡ����

����������
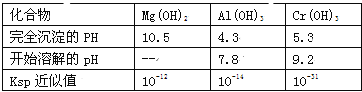
�ش��������⣺
��1�������������Һ��������ȡMgSO47H2O�����Թ�ҵ��Һ�м���������������������____��
��2�������Է�Һ��c(Mg2+)=0.1mol/L��Ϊ�ﵽ����ٵ�ʵ��Ŀ�ģ����Һ��pHӦ������_______��Χ������С�����lλ��������ҺPh=5ʱ��c(Cr3+)=__________
��3�������������NaCrO2 �����ӷ���ʽΪ_____________��
��4��������з�Ӧ�����ӷ���ʽΪ________________��
��5��������ڿ����г�����յ�Ŀ����__________________����ѡ�õ�װ����________��(�����)

��6�������������Ļ�ѧ��Ӧ����ʽΪ____________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com