
【题目】Cu2O广泛用作颜料和化工生产的催化剂。
(1)用铜作阳极,钦片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,有关转化如图所示。

将得到的Cu2O溶于稀硫酸,发现有红色固体生成,该反应中氧化剂与还原剂的质量之比为___________。图中③④两步反应的总反应离子方程式为________________。
(2)Cu2O与ZnO组成的催化剂可用于工业上合成甲醇:CO(g)+2H2(g)=CH3OH(g) △H=akJ·mol-1;按![]() 的投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,CO的平衡转化率与温度、压强的关系如图所示。
的投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,CO的平衡转化率与温度、压强的关系如图所示。

①图中压强pl、p2、p3由大到小的顺序是_________。
②a _________(填“>”或“<”) 0。
③起始时,c(H2)=0.20mol/L。c(CO)=0.10 mol/L,在p3及Tl℃下反应CO(g)+ 2H2(g)=CH3OH(g)达到平衡,该温度下反应的平衡常数为__________。
【答案】(1)1:1;2CuCl2-+2OH-=Cu2O↓+H2O+4Cl-;
(2)①p1>p2>p3;②<;③46.3L2/mol2(不写单位不扣分)
【解析】
试题分析:(1)将得到的Cu2O溶于稀硫酸,发现有红色固体生成,这说明反应中有铜生成,则反应的化学方程式为Cu2O+H2SO4=CuSO4+Cu+H2O,所以氧化亚铜既是氧化剂,也是还原剂,该反应中氧化剂与还原剂的质量之比为1:1;图中③④两步反应的总反应离子方程式为2CuCl2-+2OH-=Cu2O↓+H2O+4Cl-。
(2)①正反应是体积减小的可逆反应,温度相同时压强越大CO的转化率越大,则根据图像可知压强pl、p2、p3由大到小的顺序是p1>p2>p3;
②根据图像可知升高温度CO转化率降低,说明平衡向逆反应方向进行,所以正反应是放热反应;
③起始时,c(H2)=0.20mol/L。c(CO)=0.10 mol/L,在p3及Tl℃下反应CO(g)+ 2H2(g)=CH3OH(g)达到平衡CO的转化率是0.4,即消耗0.04mol/LCO,则根据方程式可知消耗氢气是0.08mol/L,生成甲醇是0.04mol/L,所以该温度下反应的平衡常数为![]() 。
。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
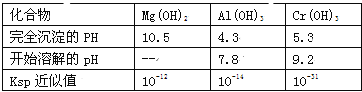
【题目】某化学兴趣小组设计如下流程,从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO42)中提取铬.

有关数据如表:
回答下列问题:
(1)步骤①所得滤液可用于制取MgSO47H2O,酸性工业废液中加入适量氧化铝的作用是____。
(2)若酸性废液中c(Mg2+)=0.1mol/L,为达到步骤①的实验目的,则废液的pH应保持在_______范围(保留小数点后l位)。当溶液Ph=5时,c(Cr3+)=__________
(3)步骤②中生成NaCrO2 的离子方程式为_____________。
(4)步骤④中反应的离子方程式为________________。
(5)步骤⑤在空气中充分灼烧的目的是__________________,可选用的装置是________。(填序号)

(6)步骤⑦发生的化学反应方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中能发生化学反应,且甲组为取代反应、乙组为加成反应的是( )
甲 | 乙 | |
A | 苯与溴水 | 乙烯与水制乙醇(催化剂) |
B | 油脂水解 | 苯与氢气(催化剂、加热) |
C | 甲烷与氯气(在光亮处) | 乙酸和乙醇的酯化反应(催化剂、加热) |
D | 乙烯与溴的四氯化碳溶液 | 乙醇与钠反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同系物的说法错误的是
①![]() 和
和![]() 互为同系物,均可以与金属钠反应。
互为同系物,均可以与金属钠反应。
②苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色。
③同系物在水中的溶解性相同,苯的同系物都难溶于水,乙醇的同系物都易溶于水。
④烷烃的密度随分子量增大而增大,液态烷烃的密度小于水的密度,固态烷烃的密度大于水的密度。
⑤同系物的分子式可以用一个通式概括,符合通式CnH2nO的物质是饱和一元醛。
⑥乙二醇和丙三醇互为同系物。
A.③④⑤⑥ B.①②③④ C.①②⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湿润的淀粉碘化钾试纸接触某气体而显蓝色,该气体可能是①Cl2 ②NO2 ③H2S ④SO2 ⑤溴蒸气 ⑥HCl中的 ( )
A.①④⑤ B.①②⑤ C.①②⑥ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯G是一种用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,它的分子式为C10H10O2,用芳香烃A为原料合成肉桂酸甲酯G的路线如下:

已知:
(1)B的官能团的名称________。
(2)D→F的反应类型是________。
(3)肉桂酸甲酯的结构简式为_________。
(4)写出A的结构简式___________。
(5)C与银氨溶液反应的化学方程式________。
(6)D转化为E的化学方程式_________。
(7)写出符合下列条件的D的同分异构体的结构简式_______。
①苯环上有两个取代基且苯环上的一氯代物有两种;
②遇FeCl3溶液显紫色
③在NaOH溶液中反应最多能消耗3mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届厦门一模】磷化氢( PH3)是一种剧毒气体,是最常用的高效熏蒸杀虫剂,也是一种电子工业原料。
(1)在密闭粮仓放置的磷化铝(AlP)片剂,遇水蒸气放出PH3气体,该反应的化学方程式为 。
(2)利用反应PH3+3HgCl2= P(HgCl)3 +3HCl,可准确测定微量的PH3。
①HgCl2溶液几乎不导电,说明HgCl2属于________________(填“共价”或“离子”)化合物。
②通过测定溶液____________变化,可测定一定体积空气中PH3的浓度。
(3)PH3的一种工业制法涉及的物质转化关系如下图所示: 
①亚磷酸属于________________元酸。
②当反应I生成的n(NaH2PO2):n(Na2HPO3) =3:1时,参加反应的n(P4):n(NaOH)= 。
(4)一种用于处理PH3废气的吸收剂成分为次氯酸钙80%、锯木屑(疏松剂)15%、活性炭2.5%、滑石粉(防结块)2.5%。
①次氯酸钙将PH3氧化为H3PO4的化学方程式为________________。
②空气中的水蒸气可加快PH3的氧化过程,其原因可能是____________。
(5)从(4)中的吸收残留物中回收磷酸氢钙(CaHPO4)的方法如下:
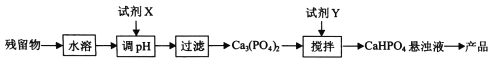
①试剂x为 (填化学式)。
②已知25℃时,H3PO4的Kal=7.5×10-3、Ka2=6.3×10-8、Ka3 =4.4×10-13。加入Y时,应控制悬浊液pH 7(填“>”、“=”或“<”),通过计算说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同分异构体的说法正确的是( )
A.乙烷的二氯代物和甲烷的二氯代物数目相同
B.丙烷的一氯代物有3种
C.苯的四氯代物有3种
D.C5H12的同分异构体有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
A. 使用Cu-Zn-Fe催化剂可大大提高生产效率
B. 反应需在300℃进行可推测该反应是吸热反应
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com