
【题目】近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如下图。下列有关说法肯定错误的是
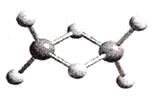
A. Al2H6在固态时所形成的晶体是分子晶体
B. 氢铝化合物可能成为未来的储氢材料和火箭燃料
C. Al2H6中含有离子键和极性共价键
D. Al2H6在空气中完全燃烧,产物为氧化铝和水
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】2015年“812”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。NaCN属于剧毒物质,若处理不当,极易污染土壤和海水。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是______________。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下受热分解,可发生不同的化学反应:
在110℃时:NH4NO3=NH3+HNO3
在185~200℃时:NH4NO3=N2O+2H2O
在230℃ 以上时,同时有弱光:2NH4NO3=2N2+O2+4H2O
在400℃ 以上时,发生爆炸:4NH4NO3=3N2+2NO2+8H2O
上述反应过程中一定破坏了______________。(填“离子键”或“共价键”或“离子键和共价键”)
(3)NaCN 的电子式为______________。下列能说明碳与氮两元素非金属性相对强弱的是______________。
A.酸性:HNO2>H2CO3
B.相同条件下水溶液的 pH:NaHCO3>NaNO3
C.CH4比NH3更稳定
D.C 与H2的化合比N2与H2的化合更容易
(4)海水中含有Ca2+、Mg2+、HCO3- 等杂质离子。用惰性电极电解海水时阴极易产生水垢,其主要成分是 Mg(OH)2和CaCO3。写出电解海水的离子方程式______________;生成CaCO3的离子方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下是电解CuCl2溶液的装置,其中c、d为石墨电极,请填写下列空格:

(1)C电极是 极,发生反应的是 (填微粒符号),该微粒在反应中 电子(“得”或“失”),发生 反应(“氧化”或“还原”), 反应现象为 ,电极反应式 。
(2)总方程式为 。
(3)上述电解反应中,被氧化的物质是 ,被还原的物质是 (填化学式)。
(4)在化学反应中发生的能量转化形式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某烷烃0.1mol完全燃烧时生成4.48LCO2(标况下),则其化学式是 。则该烷烃的结构简式是
(2)为了检验和除去下表中的各种杂质(括号里的物质),请从(I中选出适当的检验试剂,从(II选出适当的除杂试剂,将所选的答案的序号填入相应的空格内。

(I)验的试剂:A. 无水硫酸铜 B.酸性高锰酸钾溶液 C.盐酸 D.氢氧化钠溶液
(II)试剂:a.硫酸 b.酸性高锰酸钾溶液 c.新制的生石灰 d.溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计如下流程,从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO42)中提取铬.

有关数据如表:
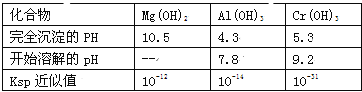
回答下列问题:
(1)步骤①所得滤液可用于制取MgSO47H2O,酸性工业废液中加入适量氧化铝的作用是____。
(2)若酸性废液中c(Mg2+)=0.1mol/L,为达到步骤①的实验目的,则废液的pH应保持在_______范围(保留小数点后l位)。当溶液Ph=5时,c(Cr3+)=__________
(3)步骤②中生成NaCrO2 的离子方程式为_____________。
(4)步骤④中反应的离子方程式为________________。
(5)步骤⑤在空气中充分灼烧的目的是__________________,可选用的装置是________。(填序号)

(6)步骤⑦发生的化学反应方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途。
(1)砷元素的基态原子价电子排布图为______________。
(2)汽车安全气囊的产生药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质,在NaN3固体中阴离子的立体构型______________。
(3)王水溶解黄金的反应如下:Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O,产物中的H[AuCl4]是配合物,它的配位体是______________,发生电离的方程式为______________
(4)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是变通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明是节能减排的有效举措,已知砷化镓的晶胞结构如图,晶胞棱长为apm。
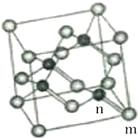
①砷化镓的化学式______________,镓原子的配位数为______________。
②砷化镓的晶胞中m位置Ga原子与n位置As原子之间的距离为________pm (用含“a”的表达式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳豆是一种减肥食品,从其中分离出一种由C、H、O三种元素组成的有机物A,为确定其结构现进行如下实验:
①相同条件下,测得A的蒸气密度是H2密度的60倍
②6gA在一定条件下完全燃烧,生成3.36L二氧化碳(标况)和1.8g水
③1mol物质A发生酯化反应,转化完全时消耗乙醇92g,等量的A能与足量的金属钠反应放出33.6L氢气(标况)试计算确定: (写过程)
(1)A的分子式____________________
(2)A的结构简式________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图只表示出与反应有关的一种反应物或生成物(无关物质已略去),其中A、C为无色气体,请填写下列空白。

(1)化合物W可能是________或__________(填化学式),C的结构式是________,
(2)D的组成元素在周期表中的位置是__________。
(3)反应③的离子方程式:________________________。
(4)已知G的极稀溶液被锌还原为NH4NO3,试写出G与锌反应的化学方程式: __________________。
(5)足量的铜与浓度均为2 mol/L的G和H2SO4的混合溶液100 mL充分反应后,转移的电子数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯G是一种用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,它的分子式为C10H10O2,用芳香烃A为原料合成肉桂酸甲酯G的路线如下:

已知:
(1)B的官能团的名称________。
(2)D→F的反应类型是________。
(3)肉桂酸甲酯的结构简式为_________。
(4)写出A的结构简式___________。
(5)C与银氨溶液反应的化学方程式________。
(6)D转化为E的化学方程式_________。
(7)写出符合下列条件的D的同分异构体的结构简式_______。
①苯环上有两个取代基且苯环上的一氯代物有两种;
②遇FeCl3溶液显紫色
③在NaOH溶液中反应最多能消耗3mol NaOH。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com