
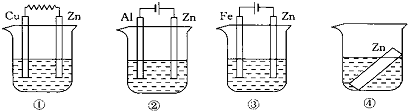
| A. | ①②③④ | B. | ②①③④ | C. | ③①④② | D. | ②①④③ |
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题

| A. | 若A是金属铁,则B溶液可使酸性高锰酸钾溶液褪色 | |
| B. | 若A、B、C中均含同一种常见金属元素,且该元素在C中以阴离子形式存在,则A溶液与C溶液可发生反应生成白色沉淀 | |
| C. | 若A、B、C的焰色反应均呈黄色,水溶液均为碱性,则X不可能为直线形分子 | |
| D. | 若A为固态非金属单质,A与X同周期,则C中所有原子可能都满足8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉溶液、CuO、HClO、Cu | |
| B. | 普通玻璃、H2O、FeCl3、葡萄糖 | |
| C. | 水银、Na2O、BaSO4、SO3 | |
| D. | KAl(SO4)2•12H2O、KClO3、NH3•H2O、CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 碳酸氢钠与盐酸反应:CO32-+2 H+═CO2↑+H2O | |
| C. | 硫酸镁溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{催化剂/△}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TiCl4溶于大量水加热制备TiO2 | |
| B. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 | |
| C. | 配制氯化亚铁溶液时需加少量铁粉 | |
| D. | 将氯化铝溶液加热蒸干并灼烧,最后得到的固体是氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{14}$C的中子数是8 | |
| B. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C互为同位素 | |
| C. | ${\;}_{6}^{14}$C转化为${\;}_{6}^{12}$C不是化学变化 | |
| D. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
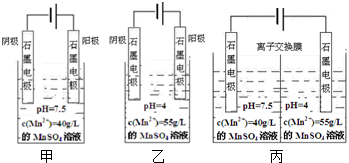
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com