
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
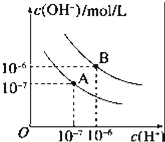
(1)95℃时水的电离平衡曲线应为___(填“A”或“B”).此温度下水的离子积KW=_____.
(2)95℃时,0.01mol/LNaOH溶液的pH=_____.
(3)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______.
(4)曲线B对应温度下,pH=2的某HA溶液中,由水电离出的氢离子浓度为_____mol/L.
(5)若在水中加入少量MgCl2固体,则对水的电离有______作用。(填“促进”或“抑制”)
【答案】B 1.0×1012 10 10:1 10-10 促进
【解析】
(1) 95℃时水的电离产生的氢离子和氢氧根离子的浓度相等,所以两者浓度都为10-6mol/L; 横轴是氢离子浓度,纵轴是氢氧根离子浓度,由水的离子积常数Kw=c(H+)×c(OH-)计算出曲线的Kw值;
(2) 根据水的离子积常数Kw=c(H+)×c(OH-)计算,据此解答;
(3) 根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积,据此解答;
(4) 曲线B对应温度下,Kw=c(H+)c(OH)=1012,据此解答;
(5)加入消耗水电离出来的氢离子或氢氧根离子的物质,促进水电离,据此解答。
(1) 95℃时水的电离产生的氢离子和氢氧根离子的浓度相等,所以两者浓度都为106mol/L,水的电离是吸热过程,温度升高电离程度增大, c (H+)、c(OH)均增大,故为曲线B;曲线B条件下c(H+)=c(OH)=106mol/L,Kw=c(H+)c(OH)=1012, 故答案为:B;1.0×1012;
(2)95℃时,0.01mol/LNaOH溶液中氢氧根离子的浓度为0.01mol/L,所以溶液中氢离子的浓度为:1010mol/L,所以溶液的pH=10,故答案为:10;
(3) n(OH)=n(H+),则V(NaOH) ·105mol·L1=V(H2SO4) ·104 mol·L1,得V(NaOH):V(H2SO4)=10:1,故答案为:10:1;
(4) 曲线B对应温度下,Kw=c(H+)c(OH)=1012,pH=2的某HA溶液中c(H+)=10-2 mol/L,由水电离出的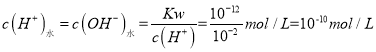 ,故答案为:10-10;
,故答案为:10-10;
(5) 若在水中加入少量MgCl2固体,镁离子会结合水电离出来的氢氧根,促进水电离,故答案为:促进。


科目:高中化学 来源: 题型:
【题目】厌氧性硫酸盐还原菌(SRB)是导致金属微生物腐蚀最为普遍的菌种,腐蚀图解如图所示。下列说法正确的是( )
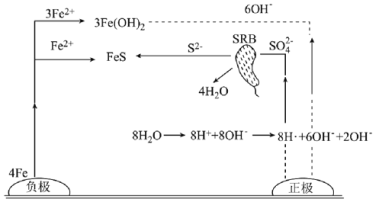
A.正极的电极反应式为8H++8e-=8H·(吸附)、SO42-+8H·(吸附)![]() S2-+4H2O
S2-+4H2O
B.正极区溶液的pH变小
C.生成1molFeS,转移6mol电子
D.若引入新细菌,一定会加速金属的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18g18O3中含有的中子数为8NA
B.0.1mol·L-1Na2CO3溶液中,所含阴离子总数大于0.1NA
C.7.8gNa2O2参与反应,转移的电子数一定为0.1NA
D.标准状况下,22.4LCO2和SO2的混合气体中含有的氧原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中烧杯里盛的是海水,铁被腐蚀由快到慢的顺序是( )
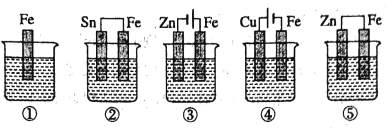
A.③>②>①>⑤>④B.④>②>①>③>⑤C.③>②>④>⑤>①D.④>⑤>②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。
(1)工业上合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
平衡常数K | 2.041 | 0.270 | 0.012 |
由表中数据判断该反应为 ________反应(填“吸热”或“放热”)。 某温度下,将2 molCO和6 molH2充入2 L的密闭容器中充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为______,此时的温度为______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH= _____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ___________________________________。
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72 + ______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 mol/L时,Cr3+沉淀完全,此时溶液的pH=______。(已知:Ksp=6.4×1031,lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色的金属,常用于金属加工、电镀等。工业以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬及获得强氧化剂Na2Cr2O7。其工艺流程如图所示:
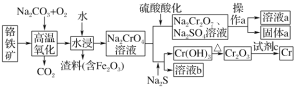
已知:高温氧化时发生反应Fe(CrO2)2+Na2CO3+O2→Na2CrO4+Fe2O3+CO2(未配平)
回答下列问题:
(1)将铬铁矿的主要成分Fe(CrO2)2写成氧化物的形式:__,高温氧化时可以提高反应速率的方法为___(写出一条即可)。
(2)Na2CrO4加入硫酸酸化的离子方程式为__;在实验室中,操作a所用到的玻璃仪器有__。
(3)Na2CrO4中铬元素化合价为__;生成1molNa2CrO4时共转移电子的物质的量为__mol。
(4)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放,可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应大于__mol·L-1,废水处理后达到国家标准才能排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置(略去夹持仪器)制取硫代硫酸钠晶体。
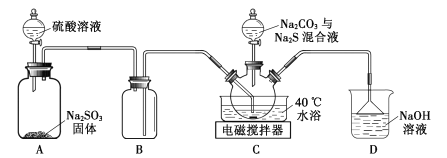
已知:①Na2S2O3.5H2O是无色晶体,易溶于水,难溶于乙醇。
②硫化钠易水解产生有毒气体。
③装置C中反应如下:Na2CO3+SO2=Na2SO3+CO2;2Na2S+3SO2=3S+2Na2SO3;S+Na2SO3![]() Na2S2O3。
Na2S2O3。
回答下列问题:
(1)装置B的作用是___。
(2)该实验能否用NaOH代替Na2CO3?___(填“能”或“否”)。
(3)配制混合液时,先溶解Na2CO3,后加入Na2S·9H2O,原因是___。
(4)装置C中加热温度不宜高于40℃,其理由是___。
(5)反应后的混合液经过滤、浓缩,再加入乙醇,冷却析出晶体。乙醇的作用是___。
(6)实验中加入m1gNa2S·9H2O和按化学计量的碳酸钠,最终得到m2gNa2S2O3·5H2O晶体。Na2S2O3·5H2O的产率为___(列出计算表达式)。[Mr(Na2S·9H2O)=240,Mr(Na2S2O3·5H2O)=248]
(7)下列措施不能减少副产物Na2SO4产生的是___(填标号)。
A.用煮沸并迅速冷却后的蒸馏水配制相关溶液
B.装置A增加一导管,实验前通人N2片刻
C.先往装置A中滴加硫酸,片刻后往三颈烧瓶中滴加混合液
D.将装置D改为装有碱石灰的干燥管
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com