
【题目】实验室用如图装置(略去夹持仪器)制取硫代硫酸钠晶体。
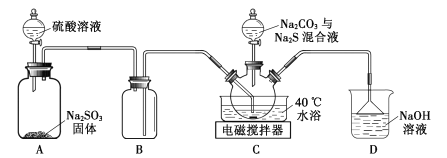
已知:①Na2S2O3.5H2O是无色晶体,易溶于水,难溶于乙醇。
②硫化钠易水解产生有毒气体。
③装置C中反应如下:Na2CO3+SO2=Na2SO3+CO2;2Na2S+3SO2=3S+2Na2SO3;S+Na2SO3![]() Na2S2O3。
Na2S2O3。
回答下列问题:
(1)装置B的作用是___。
(2)该实验能否用NaOH代替Na2CO3?___(填“能”或“否”)。
(3)配制混合液时,先溶解Na2CO3,后加入Na2S·9H2O,原因是___。
(4)装置C中加热温度不宜高于40℃,其理由是___。
(5)反应后的混合液经过滤、浓缩,再加入乙醇,冷却析出晶体。乙醇的作用是___。
(6)实验中加入m1gNa2S·9H2O和按化学计量的碳酸钠,最终得到m2gNa2S2O3·5H2O晶体。Na2S2O3·5H2O的产率为___(列出计算表达式)。[Mr(Na2S·9H2O)=240,Mr(Na2S2O3·5H2O)=248]
(7)下列措施不能减少副产物Na2SO4产生的是___(填标号)。
A.用煮沸并迅速冷却后的蒸馏水配制相关溶液
B.装置A增加一导管,实验前通人N2片刻
C.先往装置A中滴加硫酸,片刻后往三颈烧瓶中滴加混合液
D.将装置D改为装有碱石灰的干燥管
【答案】安全瓶,防止倒吸 能 碳酸钠溶液显碱性,可以抑制Na2S水解 温度过高不利于SO2的吸收,或消耗的H2SO4、Na2SO3较多,或Na2S2O3产率降低等其它合理答案 降低Na2S2O3晶体的溶解度,促进晶体析出 ![]() ×100% D
×100% D
【解析】
(1)装置B的作用是平衡压强,防止倒吸;
(2)Na2CO3的作用是与二氧化硫反应制备亚硫酸钠;
(3)Na2S是强碱弱酸盐,易发生水解;
(4)温度过高不利于二氧化硫的吸收,产品产率会降低;
(5) Na2S2O3.5H2O是无色晶体,易溶于水,难溶于乙醇;
(6)根据反应Na2CO3+SO2=Na2SO3+CO2;2Na2S+3SO2=3S+2Na2SO3;S+Na2SO3![]() Na2S2O3, 列关系式2Na2S·9H2O~3S~3Na2S2O3·5H2O,结合数据计算理论上制得Na2S2O3·5H2O晶体的质量,Na2S2O3·5H2O的产率为
Na2S2O3, 列关系式2Na2S·9H2O~3S~3Na2S2O3·5H2O,结合数据计算理论上制得Na2S2O3·5H2O晶体的质量,Na2S2O3·5H2O的产率为![]() ;
;
(7)Na2SO3易被氧化为硫酸钠,减少副产物的含量就要防止Na2SO3被氧化。
(1)装置B的作用是平衡压强,防止倒吸,则B为安全瓶防止倒吸;
(2)Na2CO3的作用是与二氧化硫反应制备亚硫酸钠,氢氧化钠和二氧化硫反应也可以生成亚硫酸钠,可以代替碳酸钠;
(3)Na2S是强碱弱酸盐,易发生水解,碳酸钠溶液显碱性,可以抑制Na2S水解;
(4) 温度过高不利于SO2的吸收,或消耗的H2SO4、Na2SO3较多,或Na2S2O3产率降低等其它合理答案;
(5) Na2S2O3.5H2O是无色晶体,易溶于水,难溶于乙醇,则乙醇的作用为:降低Na2S2O3晶体的溶解度,促进晶体析出;
(6)根据反应Na2CO3+SO2=Na2SO3+CO2;2Na2S+3SO2=3S+2Na2SO3;S+Na2SO3![]() Na2S2O3, 列关系式2Na2S·9H2O~3S~3Na2S2O3·5H2O,理论上制得Na2S2O3·5H2O晶体的质量为
Na2S2O3, 列关系式2Na2S·9H2O~3S~3Na2S2O3·5H2O,理论上制得Na2S2O3·5H2O晶体的质量为![]() g,Na2S2O3·5H2O的产率为
g,Na2S2O3·5H2O的产率为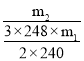 ×100%=
×100%=![]() ×100%;
×100%;
(7)A.用煮沸并迅速冷却后的蒸馏水中含氧量降低,可有效防止Na2SO3被氧化为Na2SO4,可减少副产物的产生,故A不符合题意;
B.装置A增加一导管,实验前通人N2片刻,可将装置中的空气赶走提供无氧环境,可防止Na2SO3被氧化为Na2SO4,可减少副产物的产生,故B不符合题意;
C.先往装置A中滴加硫酸,产生二氧化硫,可将装置中的空气赶走,片刻后往三颈烧瓶中滴加混合液,可减少副产物的产生,故C不符合题意;
D.将装置D改为装有碱石灰的干燥管,装置中仍然含有空气,氧气可将Na2SO3被氧化为Na2SO4,不能减少副产物产生,故D符合题意;
答案选D。


科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
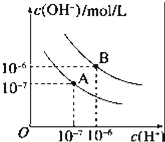
(1)95℃时水的电离平衡曲线应为___(填“A”或“B”).此温度下水的离子积KW=_____.
(2)95℃时,0.01mol/LNaOH溶液的pH=_____.
(3)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______.
(4)曲线B对应温度下,pH=2的某HA溶液中,由水电离出的氢离子浓度为_____mol/L.
(5)若在水中加入少量MgCl2固体,则对水的电离有______作用。(填“促进”或“抑制”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g) + nB(g)![]() pC(g) H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
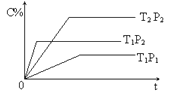
A. T1<T2 P1>P2 m+n<P Q<0B. T1>T2 P1<P2 m+n>P Q>0
C. T1<T2 P1<P2 m+n<P Q>0D. T1>T2 P1<P2 m+n>P Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯的绿色合成路线之一为:
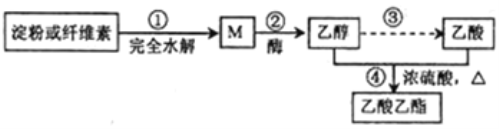
下列说法不正确的是( )
A. 加热条件下,M能与新制氢氧化铜悬浊液发生反应
B. ④的反应类型属于酯化反应,也属于取代反应
C. 淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体
D. 用饱和碳酸钠溶液可以鉴别乙醇、乙酸和乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并使产生的气体全部通过如图所示装置中,得到如表中所列的实验结果(假设产生的气体完全被吸收)。
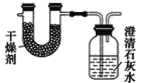
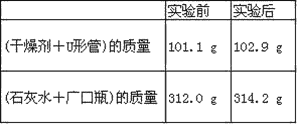
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为_____________g。
(2)生成的水中氢元素的质量为_______g。
(3)生成的二氧化碳中碳元素的质量为_______ g。
(4)该燃料中碳元素与氢元素的质量比为_______。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为_______,结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是
A.向FeBr2溶液中通入过量Cl2:![]()
B.钠与水反应:![]()
C.酸化KIO3和KI的混合溶液:![]()
D.将铜丝插入稀硝酸中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入![]() 和
和![]() 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B. 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D. 甲增加0.1mol ![]() ,乙增加0.1mol I2
,乙增加0.1mol I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氯水含有Cl2、H2O、HClO、H+、Cl-等粒子,为检验其成分,某研究性学习小组做了如下实验,请根据所做实验,按要求填空。
(1)取少量新制氯水于试管中,加入碳酸钙粉末,发现有气泡产生,则说明起作用
的成分是HCl,HCl表现出 性。
(2)取少量新制氯水于试管中,加入AgNO3溶液,发现有白色沉淀产生,则起作用的是 。
(3)取少量新制氯水于试管中,加入一块红纸,发现很快褪色,则起作用的是 。
(4)取少量新制氯水于试管中,加入FeCl2溶液,发现很快变黄,起作用的成分是Cl2,说明氯气具有 性。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com