
【题目】能正确表示下列反应的离子方程式的是
A.向FeBr2溶液中通入过量Cl2:![]()
B.钠与水反应:![]()
C.酸化KIO3和KI的混合溶液:![]()
D.将铜丝插入稀硝酸中:![]()
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃锂离子电池的资源化处理日益重要。从废旧磷酸铁锂电池的正极材料(含LiFePO4、石墨粉和铝箔等)中综合回收锂、铁和磷等的工艺流程如图所示:
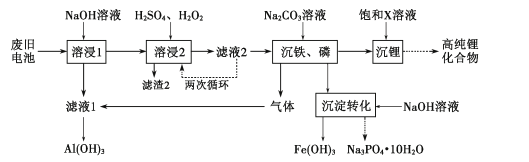
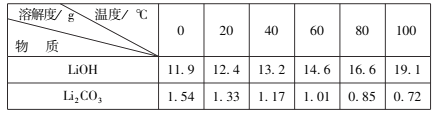
有关数据:25℃时,Ksp(FePO4)=1.3×10-22、Ksp[Fe(OH)3]=2.6×10-39。
回答下列问题:
(1)“溶浸1”中铝溶解的化学方程式为___。
(2)完成“溶浸2”反应的离子方程式___:
![]() LiFePO4+
LiFePO4+![]() H2O2+
H2O2+![]() =
=![]() Li++
Li++![]() +
+![]() H2PO4-+
H2PO4-+![]() H2O
H2O
(3)“滤渣2”的主要成分是___。
(4)“滤液2”循环两次的目的是___。
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为__。实验中,铁、磷的沉淀率结果如图所示。碳酸钠浓度大于30%后,铁沉淀率仍然升高,磷沉淀率明显降低,其可能原因是___。
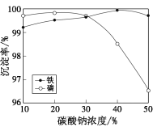
(6)“沉淀转化”反应:FePO4+3OH-Fe(OH)3+PO43-。用此反应的化学平衡常数说明转化能否完全___?
(7)为了充分沉淀,“沉锂”时所用的X和适宜温度是___(填标号)。
A.NaOH20-40℃ B.NaOH80-100℃
C.Na2CO320-40℃ D.Na2CO360-80℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置(略去夹持仪器)制取硫代硫酸钠晶体。
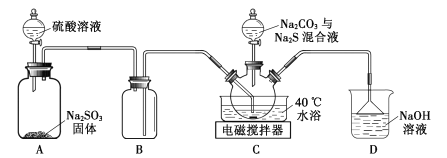
已知:①Na2S2O3.5H2O是无色晶体,易溶于水,难溶于乙醇。
②硫化钠易水解产生有毒气体。
③装置C中反应如下:Na2CO3+SO2=Na2SO3+CO2;2Na2S+3SO2=3S+2Na2SO3;S+Na2SO3![]() Na2S2O3。
Na2S2O3。
回答下列问题:
(1)装置B的作用是___。
(2)该实验能否用NaOH代替Na2CO3?___(填“能”或“否”)。
(3)配制混合液时,先溶解Na2CO3,后加入Na2S·9H2O,原因是___。
(4)装置C中加热温度不宜高于40℃,其理由是___。
(5)反应后的混合液经过滤、浓缩,再加入乙醇,冷却析出晶体。乙醇的作用是___。
(6)实验中加入m1gNa2S·9H2O和按化学计量的碳酸钠,最终得到m2gNa2S2O3·5H2O晶体。Na2S2O3·5H2O的产率为___(列出计算表达式)。[Mr(Na2S·9H2O)=240,Mr(Na2S2O3·5H2O)=248]
(7)下列措施不能减少副产物Na2SO4产生的是___(填标号)。
A.用煮沸并迅速冷却后的蒸馏水配制相关溶液
B.装置A增加一导管,实验前通人N2片刻
C.先往装置A中滴加硫酸,片刻后往三颈烧瓶中滴加混合液
D.将装置D改为装有碱石灰的干燥管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
A. A的平均反应速率是0.010 molL﹣1s﹣1
B. 容器中含D物质的量至少为0.45 mol
C. 容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D. 容器中A的物质的量一定增加了0.30 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:

A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
2CrO42-(黄色)+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
实验1:向试管中加入4mL 0.1mol·L-1 K2Cr2O7溶液,再加数滴1mol·L-1 NaOH溶液,观察溶液颜色变化;
实验2:将上述溶液分成两份向其中一份中滴加1mol·L-1 HNO3,观察溶液颜色变化,并和另一份做对比_____。
实验现象 | 实验结论 | |
实验1 | ||
实验2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
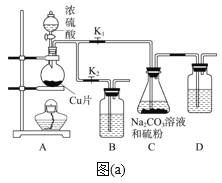
【题目】硫代硫酸钠(Na2S2O3·5H2O)俗称“海波”,应用非常广泛。工业上可以用亚硫酸钠法(亚硫酸钠和硫粉通过化合反应)制得,装置如图(a)所示。
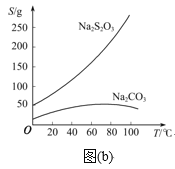
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图(b)所示。
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后,检查A、C装置气密性的操作是_____。
步骤2:加入药品,打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。装置B、D的作用是________。
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH接近7时,打开K2、关闭K1并停止加热;C中溶液要控制pH的理由是_____。
步骤4:过滤C中的混合液,将滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:
向足量的新制氯水中滴加Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由:____。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00mL。部分反应的离子方程式为:a.Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;b.I2+2S2O32-=2I-+S4O62-。则该废水中Ba2+的物质的量浓度为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com