
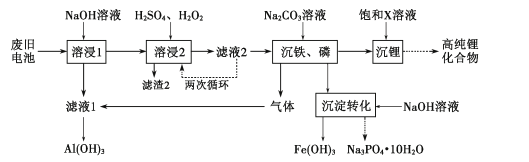
【题目】废弃锂离子电池的资源化处理日益重要。从废旧磷酸铁锂电池的正极材料(含LiFePO4、石墨粉和铝箔等)中综合回收锂、铁和磷等的工艺流程如图所示:
有关数据:25℃时,Ksp(FePO4)=1.3×10-22、Ksp[Fe(OH)3]=2.6×10-39。
回答下列问题:
(1)“溶浸1”中铝溶解的化学方程式为___。
(2)完成“溶浸2”反应的离子方程式___:
![]() LiFePO4+
LiFePO4+![]() H2O2+
H2O2+![]() =
=![]() Li++
Li++![]() +
+![]() H2PO4-+
H2PO4-+![]() H2O
H2O
(3)“滤渣2”的主要成分是___。
(4)“滤液2”循环两次的目的是___。
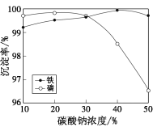
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为__。实验中,铁、磷的沉淀率结果如图所示。碳酸钠浓度大于30%后,铁沉淀率仍然升高,磷沉淀率明显降低,其可能原因是___。
(6)“沉淀转化”反应:FePO4+3OH-Fe(OH)3+PO43-。用此反应的化学平衡常数说明转化能否完全___?
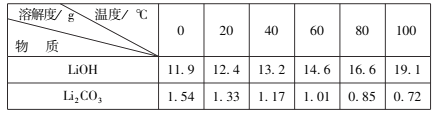
(7)为了充分沉淀,“沉锂”时所用的X和适宜温度是___(填标号)。
A.NaOH20-40℃ B.NaOH80-100℃
C.Na2CO320-40℃ D.Na2CO360-80℃
【答案】2Al+2H2O+2NaOH=2NaAlO2+3H2↑ 2LiFePO4+H2O2+6H+=2Li++2Fe3++2H2PO4-+2H2O 石墨 提高浸出液的浓度(或提高双氧水和硫酸的利用率等其他合理答案) Fe3++2H2PO4-+CO32-= FePO4↓+ CO2↑+ H2O Na2CO3水解产生的c(OH-)增大,与Fe3+结合生成Fe (OH)3沉淀,而使留在溶液中的PO43-增大 K=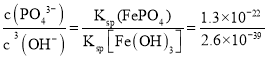 =5.0×1016,K很大,说明反应完全进行 D
=5.0×1016,K很大,说明反应完全进行 D
【解析】
废旧磷酸铁锂电池的正极材料(含LiFePO4、石墨粉和铝箔等)加入氢氧化钠进行减溶,铝箔与氢氧化钠反应生成偏铝酸钠,过滤后得到滤液1,滤液1为偏铝酸钠溶液,过滤后的滤渣再加入过量浓硫酸进行酸溶,同时加入双氧水,将亚铁离子氧化为三价铁,并进行多次循环,确保亚铁离子全部转化,在进行过滤得到滤渣2和滤液2,滤渣2为石墨粉,滤液2主要含有Fe3+、Li+、H2PO4-和SO42-溶液,向滤液2加入碳酸钠,Fe3+、H2PO4-与碳酸钠反应,转化为磷酸铁沉淀和二氧化碳,生成的二氧化碳气体通入滤液1中反应生成氢氧化铝,磷酸铁中加入氢氧化钠溶液转化为氢氧化铁和磷酸钠晶体,向沉铁、磷后的溶液加入碳酸钠得到碳酸锂沉淀,再对碳酸锂进行一系列处理最后得到高纯锂化合物,据此分析解答。
(1)根据分析,“溶浸1”中铝溶解的化学方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑;
(2)完成“溶浸2”为LiFePO4与过量浓硫酸进行酸溶,同时加入双氧水,将亚铁离子氧化为三价铁,离子方程式:2LiFePO4+H2O2+6H+=2Li++2Fe3++2H2PO4-+2H2O;
(3)根据分析,“滤渣2”的主要成分是石墨;
(4)“滤液2”循环两次的目的是提高浸出液的浓度(或提高双氧水和硫酸的利用率等其他合理答案)
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为Fe3++2H2PO4-+CO32-= FePO4↓+ CO2↑+ H2O;实验中,铁、磷的沉淀率结果如图所示。碳酸钠浓度大于30%后,铁沉淀率仍然升高,磷沉淀率明显降低,其可能原因是Na2CO3水解产生的c(OH-)增大,与Fe3+结合生成Fe (OH)3沉淀,而使留在溶液中的PO43-增大;
(6)“沉淀转化”反应:FePO4+3OH-Fe(OH)3+PO43-。K=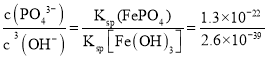 =5.0×1016,K很大,说明反应完全进行。
=5.0×1016,K很大,说明反应完全进行。
(7)结合表格数据,碳酸锂的溶解度远小于氢氧化锂,为了充分沉淀,“沉锂”时所用的X应为碳酸钠,60-80℃左右溶解度较小,答案选D。


科目:高中化学 来源: 题型:
【题目】有![]() 、CH3CH2OH、CH3CH2Br、NH4Cl四种无色液体,只有一种试剂就能把它们鉴别开,这种试剂是( )
、CH3CH2OH、CH3CH2Br、NH4Cl四种无色液体,只有一种试剂就能把它们鉴别开,这种试剂是( )
A.溴水B.NaOH溶液C.Na2SO4溶液D.KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。

已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于__________________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸环酯类化合物是一种重要的化工试剂。其一种合成路线如图:
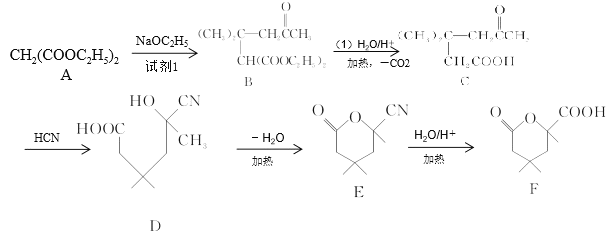
已知:2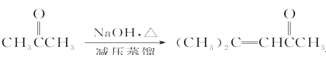 (试剂1)
(试剂1)
回答下列问题:
(1)按系统命名法,CH2(COOC2H5)2的名称为______。
(2)A生成B的反应类型为______,化合物E中官能团的名称为______,F的分子式为______。
(3)D生成E的化学方程式为______。
(4)芳香族化合物G为E的同分异构体,符合下列要求的同分异构体有______种。
Ⅰ.1molG可与2molNa2CO3反应
Ⅱ.含有官能团—NH2
Ⅲ.苯环上有三个取代基,且苯环上有两种等效氢
其中核磁共振氢谱有五组峰,峰面积之比为6∶2∶2∶2∶1的结构简式为______。
(5)写出用甲醛、乙醛和CH2(COOC2H5)2为原料制备化合物![]() 的合成路线(其他试剂任选)。_______。
的合成路线(其他试剂任选)。_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g) + nB(g)![]() pC(g) H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
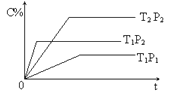
A. T1<T2 P1>P2 m+n<P Q<0B. T1>T2 P1<P2 m+n>P Q>0
C. T1<T2 P1<P2 m+n<P Q>0D. T1>T2 P1<P2 m+n>P Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯的绿色合成路线之一为:
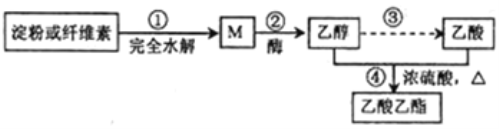
下列说法不正确的是( )
A. 加热条件下,M能与新制氢氧化铜悬浊液发生反应
B. ④的反应类型属于酯化反应,也属于取代反应
C. 淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体
D. 用饱和碳酸钠溶液可以鉴别乙醇、乙酸和乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是
A.向FeBr2溶液中通入过量Cl2:![]()
B.钠与水反应:![]()
C.酸化KIO3和KI的混合溶液:![]()
D.将铜丝插入稀硝酸中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用水合肼(N2H4H2O)还原法制取碘化钠,工艺流程如图:
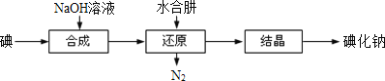
已知:I2与NaOH溶液反应,其氧化产物与还原产物的物质的量之比为1:5
(1)写出水合肼还原过程的化学反应方程式_____。
(2)若加入的水合肼已过量,请设计实验方案检验_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com