
(15分)现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
|
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
|
B元素原子的核外p电子数比s电子数少1 |
|
C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
|
D原子核外所有p轨道全满或半满 |
|
E元素的主族序数与周期数的差为4 |
|
F是前四周期中电负性最小的元素 |
|
G在周期表的第七列 |
⑴已知BA5 为离子化合物,写出其电子式 .
⑵B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
⑶某同学根据上述信息,推断C基态原子的核外电子排布为: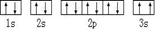
该同学所画的电子排布图违背了 .
⑷G位于 族 区,价电子排布式为 .
⑸DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
⑹检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是 .
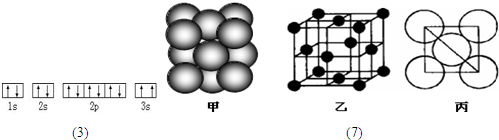
⑺若某单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本模式中的 .

⑴(2分)
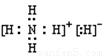
⑵3(1分),纺锤形(1分) ⑶泡利原理(1分)
⑷第ⅦB(2分) d (1分),3d54s2(1分)⑸sp3(1分),三角锥形(1分)
⑹焰色反应(1分), 当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量。 (3分) (7)12 铜型
【解析】宇宙中最丰富的元素是氢和氧,但只有氢元素的核外电子数和电子层数相等,故A是H。元素原子的核外p电子数比s电子数少1个是N元素,B是N。因为C原子的第三和第四电离能远远大于第一和第二电离能,所以C的化合价应该是+2价,又因为原子序数大于N的,即C是Mg。原子核外所有p轨道全满或半满的短周期元素是P,即D是P。E的原子序数比P的大且属于短周期,即E是第三周期的元素,由于主族序数与周期数的差为4,属于E属于第 ⅦA,即为Cl。第四周期元素中电负性最小的是K元素,故F是K。第四周期第七列的元素是ⅦB的Mn元素。
(1)NH5是离子化合物,说明是由NH4+和H-构成的,故电子式为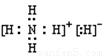
(2)N元素基态原子中能量最高的电子是2p3的电子,其电子云在空间有3个方向,原子轨道呈纺锤形。
(3)一个原子轨道中最多只能容纳2个电子,且自旋方向相反,这就是泡利原理。
(4)Mn属于d区元素。元素原子的最外层电子称作价电子,对于副族元素次外层或倒数第三层的电子也可以称作价电子,所以锰的价电子排布式是3d54s2。
(5)PCl3分子中含有的孤对电子对数是1对,再加上中性原子的3个α键,共4个,所以是sp3杂化。空间构型是四面体,但由于含有1对孤对电子,所以实际的构型是三角锥形。
(6)检验K元素常用焰色反应。之所以会产生该现象是由于电子跃迁的结果。
(7)根据甲的结构特点可以得出该单质晶体中原子的堆积方式为四种基本模式中的铜型。由乙、丙的结构可看出与1个原子周围最近的原子(以立方体的顶点为中心)有3个,即相邻的3个面。由于1个顶点可以组成8个立方体,但每个面是2个立方体共用的,所以配位数应是12.


科目:高中化学 来源: 题型:阅读理解
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |


 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了查看答案和解析>>
科目:高中化学 来源: 题型:
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
查看答案和解析>>
科目:高中化学 来源: 题型:
[物质结构与性质] 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1) 已知BA5 为离子化合物,写出其电子式
(2) B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
(3) 某同学根据上述信息,推断C基态原子的核外电子排布为,![]()
该同学所画的电子排布图违背了
(4) G位于 族 区,价电子排布式为
(5) DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为
(6) 检验F元素的方法是 ,请用 原子结构的知识解释产生此现象的原因是
原子结构的知识解释产生此现象的原因是
(7) F元素的晶胞如右图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为 cm
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com