
����Ŀ��ijУѧ��Ϊ̽�������巢����Ӧ��ԭ��������ͼװ�ý���ʵ�飮
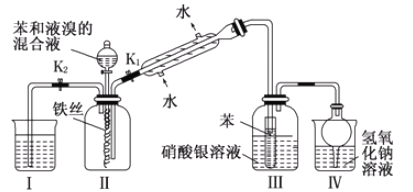
�������֪ʶ�ش��������⣺
��1��ʵ�鿪ʼʱ���ر�K1������K2�ͷ�Һ©���������μӱ���Һ��Ļ��Һ����Ӧ��ʼ����Ӧ�Ļ�ѧ����ʽ_____����һ������ڣ�����ƿ�۲쵽_____�����п��ܹ۲쵽��������____
��2������ʵ��װ�����ܷ�ֹ������װ����_____����װ����ţ���
��3����Ӧ������Ҫʹװ�ã�I���е�ˮ������װ�ã����У�����������Ŀ����______
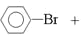
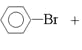
���𰸡�![]() +Br2
+Br2![]()
 HBr ��ɫ��״Һ�壨�屽�� �а������֣����ƿ����Һ����dz��ɫ�廯���������� III��IV ��ȥ�廯�����壬�����ݳ���Ⱦ����
HBr ��ɫ��״Һ�壨�屽�� �а������֣����ƿ����Һ����dz��ɫ�廯���������� III��IV ��ȥ�廯�����壬�����ݳ���Ⱦ����
��������
��1������Һ�������������������·���ȡ����Ӧ�����屽���廯�⣻�ڣ����������屽���������廯������������Һ��Ӧ�����廯����
��2�����е��ܿ��ڱ���Һ�����ϣ�����ܿɷ�������
��3�������廯��������ˮ������
��1������Һ�������������������·���ȡ����Ӧ�����屽���廯�⣬��Ӧ����ʽ��![]() +Br2
+Br2![]()
 HBr���ڣ����������屽���������к�ɫ��״Һ�壻�������廯������������Һ��Ӧ�����廯�����������а������֣����ƿ����Һ����dz��ɫ�廯���������ɣ�
HBr���ڣ����������屽���������к�ɫ��״Һ�壻�������廯������������Һ��Ӧ�����廯�����������а������֣����ƿ����Һ����dz��ɫ�廯���������ɣ�
��2�����е��ܿ��ڱ���Һ�����Ͽɷ����������������ϴ�ɷ�����������ʵ��װ�����ܷ�ֹ������װ���Т��IV��
��3���廯��������ˮ����Ӧ������Ҫʹװ�ã�I���е�ˮ������װ�ã����У����Գ�ȥ�廯�����壬�����ݳ���Ⱦ������


 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ A(g) + 2B(g) ![]() 2C(g) ��H��0����һ�������´ﵽƽ�⣬���ı����������仯���������������С�����䡱������ո�
2C(g) ��H��0����һ�������´ﵽƽ�⣬���ı����������仯���������������С�����䡱������ո�
��1�������¶ȣ�B��ת����_____________��v(��)____________��v(��)____________��
��2�������¶Ⱥ�ѹǿ���䣬����������壬��C�����ʵ���_____________��A��ת����_____________��
��3�� �����¶Ⱥ�������䣬����������壬A��ת����_____________��
��4�����¶Ⱥ�������䣬��Ӧ�ӿ�ʼ��ƽ�⣬������������ܶ�_____________��ѹǿ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��WΪ���ֶ�����Ԫ�أ�X��Y��Z��ԭ���������������ͬ����Ԫ�أ�������������֮��Ϊ15��X��Z���γ�XZ2���ӣ�Y��M�γɵ���̬�������ڱ�״���µ��ܶ�Ϊ0.76 g��L��1��W����������X��Y��Z��M����Ԫ��������֮�͵�1/2������˵����ȷ����
A. ԭ�Ӱ뾶��W>Z>Y>X>M
B. ������̬�⻯����ȶ��ԣ�X��Y��Z
C. 1 mol WM��������ˮ����ȫ��Ӧ����ת��2 mol����
D. ��X��Y��Z��M����Ԫ���γɵĻ�����һ���������Ӽ������й��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������(NASA)�������ࣺ��������ʳ�����ܽ���Ч��������ЧӦ������������ɽ�ڻ���������һϵ�����ѡ��������(NASA)������Ա������һ�ֱȶ�����̼��104��������������������ȫ������(C3F8)�������������ú�����й�ȫ�������˵����ȷ����
A. �����е�����̼ԭ�ӿ��ܴ���ͬһֱ����
B. ȫ������ĵ���ʽΪ��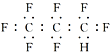
C. �ɱ���ת��Ϊȫ������ķ�ӦΪȡ����Ӧ
D. ȫ���������ȫ����ϩ(CF2=CFCF3)��H2�ӳɵõ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ȱ���3��ͬ���칹�壬�����ȱ���ͬ���칹���У�������
A.2��
B.3��
C.4��
D.5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mL 0.2 mol/L H2A��Һ�еμ�0.2 mol/L NaOH��Һ�������ʵ����ı仯��ͼ��ʾ������˵����ȷ����
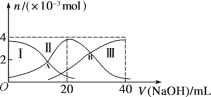
A. ��V(NaOH)=20 mLʱ����Һ������Ũ�ȹ�ϵ��c(Na��)>c(HA��)>c(A2��)>c(H��)>c(OH��)
B. ��V(NaOH)=30 mLʱ�����У�2c(H+) + c(HA-) +2c(H2A) =c(A2-) +2c(OH-)
C. ����������20 mL NaOH��Һ��������Һ���ټ���ˮ�Ĺ����У�pH��С
D. ��A��B�����Ӧ����ҺpHֵ�ֱ�Ϊa��b����H2A![]() 2H++A2-��K=10-a-b
2H++A2-��K=10-a-b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£���ʹCH3COONa��Һ��c(CH3COO-)/c(Na+)�ı�ֵ��������Һ�м���������������ȷ���Ǣٹ���NaOH �ڹ���KOH �۹���NaHS �ܹ���CH3COONa �ݱ����� ��ˮ
A. �ڢۢܢ� B. �ڢܢ� C. �ڢݢ� D. �٢ݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A���֣����Ӣɰ(ZrO2��SiO2����������Fe2O3��Al2O3��SiO2������)�Ʊ�ZrO2���������£�

��֪����ZrO2��ǿ������Һ����ZrO32-��ʽ���ڣ���ǿ������Һ����ZrO2+��ʽ���ڡ�
�ڲ��ֽ���������ʵ�������¿�ʼ��������ȫ������pH���±���
Mn+ | Fe3+ | Al3+ | ZrO2+ |
��ʼ����ʱpH | 1.9 | 3.3 | 6.2 |
������ȫʱpH | 3.8 | 5.6 | 8.0 |
(1)����I����Ҫ�IJ�������Ϊ___________������I���˵õ���Һa���ɵõ�_________��
(2)�Ӱ�ˮ����Һa�е���pH�ĵķ�Χ��________________��
(3)����II��õ���Һb������II������II����������£�
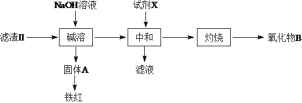
������B�Ļ�ѧʽΪ__________�����Լ�XΪ���ᣬȱ����___________��
(4)����III���õ�Zr(OH)4��õ�ij����Һ�������Һ�м���CaCO3��ĩ�����ȣ��õ��������塣�÷�Ӧ�����ӷ���ʽΪ_____________________________��
(5)���백ˮ����Һb���������ӷ���ʽΪ__________________________��
(6)Ϊ�õ�������ZrO2��Zr(OH)4��Ҫϴ�ӣ�����Zr(OH)4�Ƿ�ϴ�Ӹɾ��ķ�����______________��
B���֣��Ѿ����Ǵ���������Ѵ������в�ѡ��������Ҫ�ɷ�ΪFeTiO3����������;�dz��㷺���Ѱ۵�ԭ�ϡ����Ѿ���ʯΪԭ���Ʊ������ѵ���������ͼ��ʾ(ijЩ���˹����Ѻ���)����֪ǿ������Һ�У�+4�۵���Ԫ����TiO2+��ʽ���ڣ������Ѳ�����ϡ���������ᡣ�ش��������⣺

(1)�����������������__________________��
(2)����K�׳��̷�������K�Ļ�ѧʽΪ____________��
(3)��д����ҺC�����Ʊ���������Ļ�ѧ����ʽ__________________________________��
(4)�����������Ļ���̿�������Ļ�ѧ����ʽΪ_______________����֪TiO2+2Cl2![]() TiCl4+O2Ϊ���ȷ�Ӧ���Ҹ������·�ӦҲ�ܹ�������Ϊ���Ʊ�TiCl4�����л�Ҫ�������̿���Խ���ԭ��_________________��
TiCl4+O2Ϊ���ȷ�Ӧ���Ҹ������·�ӦҲ�ܹ�������Ϊ���Ʊ�TiCl4�����л�Ҫ�������̿���Խ���ԭ��_________________��
(5)����F�����F��������_____________________��
(6)��ҺH��_________������Ϊ___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������þ�����Ļ����Ͷ��100ml�����У�����ȫ���ܽ����������Һ�м���NaOH��Һ�����ɳ��������ʵ��������NaOH��Һ�������ϵ��ͼ��ʾ��
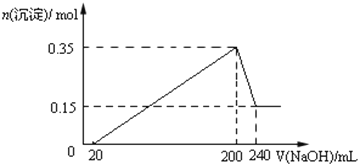
��1��ԭ�������þ������������Ϊ_______
��2��NaOH��Һ�����ʵ���Ũ��Ϊ_______ molL��1
��3�����ɵ������ڱ�״���µ����Ϊ_______ L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com