
【题目】恒温条件下,欲使CH3COONa溶液中c(CH3COO-)/c(Na+)的比值增大,可在溶液中加入下列物质中正确的是①固体NaOH ②固体KOH ③固体NaHS ④固体CH3COONa ⑤冰醋酸 ⑥加水
A. ②③④⑤ B. ②④⑤ C. ②⑤⑥ D. ①⑤⑥
【答案】B
【解析】
CH3COONa溶液中存在CH3COO-+H2O![]() CH3COOH+OH-,根据平衡移动规律进行分析。
CH3COOH+OH-,根据平衡移动规律进行分析。
CH3COONa溶液中存在CH3COO-+H2O![]() CH3COOH+OH-,
CH3COOH+OH-,
①加入固体NaOH、使平衡左移,c(CH3COO-)将增多,但是c(Na+)增加得多,c(CH3COO-)/c(Na+)的比值减小;
②加入固体KOH、使平衡左移,c(CH3COO-)将增多,c(Na+)不变,所以c(CH3COO-)/c(Na+)的比值增大;
③加入固体NaHS ,c(CH3COO-)变化很小,c(Na+)明显增大,故c(CH3COO-)/c(Na+)的比值减小;
④加入固体CH3COONa,水解率将减小,c(CH3COO-)/c(Na+)的比值增大;
⑤加入冰醋酸,使平衡左移,c(CH3COO-)将增多,c(Na+)不变,所以c(CH3COO-)/c(Na+)的比值增大;
⑥加水稀释,平衡右移,水解率增大,c(CH3COO-)浓度减小的程度大,c(CH3COO-)/c(Na+)的比值减小;
综上所述,符合题意的有②④⑤,本题选B。


科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随PH的变化如图所示。下列叙述错误的是
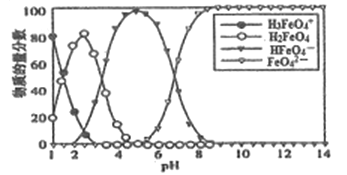
A. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4、K3=5.0×10-8.当pH=4时,溶渡中c(HFeO4-)/c(H2FeO4)=1.2
B. 向pH=5的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
C. PH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)>c(HFeO4-)
D. 为获得尽可能纯净的高铁酸盐,应控制PH≥9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是 ( )
A.某特定反应的平衡常数仅是温度的函数
B.化学平衡发生移动,平衡常数必发生变化
C.其他条件一定时,平衡常数发生变化,化学平衡必定发生移动
D.催化剂不能改变平衡常数的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生为探究苯与溴发生反应的原理,用如图装置进行实验.
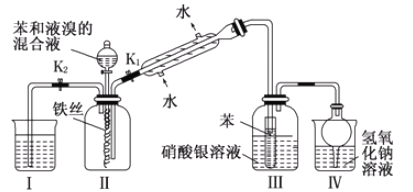
根据相关知识回答下列问题:
(1)实验开始时,关闭K1,开启K2和分液漏斗活塞,滴加苯和液溴的混合液,反应开始,反应的化学方程式_____。过一会儿,在(Ⅱ)中瓶底观察到_____(Ⅲ)中可能观察到的现象是____
(2)整套实验装置中能防止倒吸的装置有_____(填装置序号)。
(3)反应结束后要使装置(I)中的水倒吸入装置(Ⅱ)中,这样操作的目的是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答下列问题:
(1)B和A形成的10电子化合物的电子式是_______
(2)A、B、C、E可形成两种酸式盐(均由四种元素组成),两种酸式盐相互反应的离子方程式为_________
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲和乙反应的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氮的氧化物和灼热的铁按4NxOy+3yFe=yFe3O4+2xN2的反应式进行反应。在一个特定的实验中,2mol该氧化物与足量红热的铁完全反应,生成1molN2和1molFe3O4。该氧化物的化学式为( )
A.NOB.NO2C.N2OD.N2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是最基本的有机化工原料之一。工业上可用二氧化碳和氢气反应来生产甲醇。
(1)已知气态甲醇的燃烧热为a kJ/mol,2H2(g)+O2(g)= 2H2O(g) ΔH=-bkJ/mol;H2O(g)=H2O(l) ΔH= -ckJ/mol。 则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH=_________。
CH3OH(g)+H2O(g)的ΔH=_________。
(2)某温度下,在2 L密闭容器中,充入2.4 mol CO2和4.4 mol H2,发生合成甲醇的反应,测得甲醇的物质的量随时间的变化图像如下图中的曲线I,则前4分钟ν(CO2)=__________;若在1 min时,改变某一反应条件,曲线I变为曲线II,则改变的条件为___________;该温度下反应的化学平衡常数为___________。
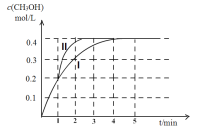
(3)在恒压的条件下,下列选项能说明CO2+3H2![]() CH3OH+H2O反应已达平衡状态的是______。
CH3OH+H2O反应已达平衡状态的是______。
A、ν正(H2): ν逆(CH3OH)=3:1
B、混合气体的密度不再变化
C、混合气的平均摩尔质量不再变化
D、反应中H2O与CH3OH的物质的量浓度之比为1:1,且比值保持不变
(4)在另一温度下发生合成甲醇的反应,关闭K,向A容器中充入1 mol CO2和4 mol H2,向B容器中充入1.2 mol CO2和4.8 mol H2,两容器分别发生上述反应。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为0.9a L,维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为______L(不考虑温度的变化,P为可自由滑动活塞,不考虑活塞的摩擦力)。
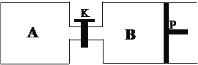
(5)一定条件下甲醇可进一步氧化转化为甲酸。室温下,将amol/L的甲酸与bmol/L的NaOH溶液等体积混合,体系中存在c(Na+)=c(HCOO-),试用含a和b的代数式表示甲酸的电离常数为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图所示装置发生铜与稀H2SO4的反应。该装置工作时,下列说法正确的是( )
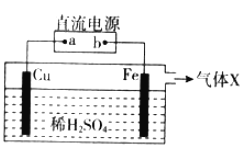
A. a为直流电源的正极B. 气体X为O2
C. SO42-向Fe电极附近移动D. 该装置能证明Cu比Fe活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
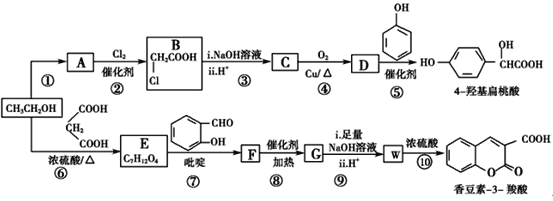
【题目】工业上以乙醇为原料经一系列反应可以得到4-羟基扁桃酸和香豆素-3-羧酸,二者的合成路线如下(部分产物及条件未列出):
已知:Ⅰ.RCOOR′+R″OH![]() RCOOR″+R′OH;
RCOOR″+R′OH;
Ⅱ. 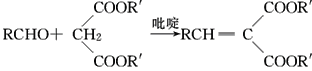 (R,R′,R″表示氢原子、烷基或芳基)
(R,R′,R″表示氢原子、烷基或芳基)
回答下列问题:
(1)反应②属于取代反应,则A中官能团的名称是________
(2) 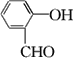 的名称是________,反应⑤的反应类型为________。
的名称是________,反应⑤的反应类型为________。
(3)反应⑥的化学方程式是________________________________________。
(4)已知G分子中含有2个六元环。下列有关说法正确的是________(填标号)。
a.核磁共振仪可测出E有5种类型的氢原子
b.质谱仪可检测F的最大质荷比的值为236
c.G分子式为C12H10O4
d.化合物W能发生加聚反应得到线型高分子化合物
(5)某芳香化合物Q是4-羟基扁桃酸的同分异构体,具有下列特征:①苯环上只有3个取代基;②能发生水解反应和银镜反应;③1 mol Q最多能消耗3 mol NaOH。Q共有________种(不含立体异构)
(6)仔细观察由乙醇合成香豆素-3-羧酸的过程,结合相关信息,当乙醇与丙二酸的物质的量的比为________时,只许3步即可完成合成路线。请写出合成路线_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com