
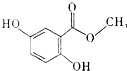
| A. | 分子式为C8H6O4 | |
| B. | 所有的碳原子可能在同一平面内 | |
| C. | 能发生消去反应 | |
| D. | 每摩尔龙胆酸甲酯最多与4molH2反应 |
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2都属于氧化物 | B. | H2SO4、CH3COOH都属于酸 | ||
| C. | 烧碱、纯碱都属于碱 | D. | Na2CO3、NaHCO3都属于盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解、石油分馏、煤的干馏都是化学变化 | |
| B. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| C. | 在一定条件下,苯和液溴、硝酸作用生成溴苯、硝基苯都属于取代反应 | |
| D. | 苯和甲苯都不属于芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 苯酚钠溶液中通入CO2生成苯酚,则碳酸的酸性比苯酚强 | |
| C. | 乙醇、乙醛和溴乙烷可以用银氨溶液鉴别 | |
| D. | 苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol氦气含有的原子数为NA | |
| B. | 常温常压下,8g甲烷中含有的电子数为5NA | |
| C. | 22 g CO2 与标准状况下11.2 L O2含有相同分子数 | |
| D. | 标准状况下,11.2L四氯化碳所含分子数 0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
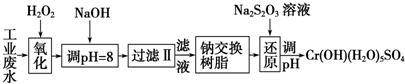
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com