
����Ŀ���������ʵ�飺����ͼ1��ʾ��װ����ȡ�����飻�ڽ��������������ʵ�飮���Թ�I�����μ���2mL ����ˮ��4mLŨ���ᡢ2mL 95%���Ҵ���3g�廯�Ʒ�ĩ�����Թܢ���ע������ˮ�����ձ���ע������ˮ�������Թ�I����״̬�����Ӻ���ȴ���Իش��������⣺ 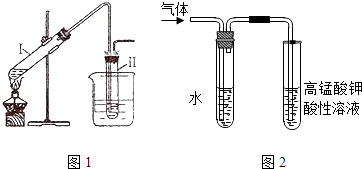
��1���Թ�I��Ũ�������廯�Ƽ��ȷ�Ӧ���������ᣬд�����������Ҵ��ڼ���ʱ��Ӧ�Ļ�ѧ����ʽ
��2��������ķе�ϵͣ��ӷ���Ϊ��ʹ�������������Թܢ��У����ٻӷ���ͼ1�в�ȡ�Ĵ�ʩ����
��3���ڽ�����������NaOH�Ҵ���Һ���ȵ�����ʵ��ʱ�������ɵ�����ͨ��ͼ2��ʾ��װ�ã�����ͼ2װ�ý���ʵ���Ŀ������ͼ���ұ��Թ��е���������ˮ�������� ��
���𰸡�
��1��HBr+C2H5OH ![]() C2H5Br+H2O
C2H5Br+H2O
��2���Թܢ����ϴ��е��ܵ����Ӳ������м�ˮ�����Թܢ����ʢ����ˮ���ձ���
��3����֤���ɵ���������ϩ������֤��������NaOH������ȥ��Ӧ�IJ�������������Һ���Ϻ�ɫ��ȥ����ȥ�����л��е������Ҵ�������
���������⣺��1�����������Ҵ��ڼ���ʱ������ȡ����Ӧ�����������ˮ����ӦΪHBr+C2H5OH ![]() C2H5Br+H2O�����Դ��ǣ�HBr+C2H5OH
C2H5Br+H2O�����Դ��ǣ�HBr+C2H5OH ![]() C2H5Br+H2O����2��������ķе�ϵͣ��ӷ���Ϊ��ʹ�������������Թܢ��У����ٻӷ���ͼ1�в�ȡ�Ĵ�ʩ���Թܢ����ϴ��е��ܵ����Ӳ������м�ˮ�����Թܢ����ʢ����ˮ���ձ��С�ʹ�ó����ܵȣ�
C2H5Br+H2O����2��������ķе�ϵͣ��ӷ���Ϊ��ʹ�������������Թܢ��У����ٻӷ���ͼ1�в�ȡ�Ĵ�ʩ���Թܢ����ϴ��е��ܵ����Ӳ������м�ˮ�����Թܢ����ʢ����ˮ���ձ��С�ʹ�ó����ܵȣ�
���Դ��ǣ��Թܢ����ϴ��е��ܵ����Ӳ������м�ˮ�����Թܢ����ʢ����ˮ���ձ��У���3����������NaOH�Ҵ���Һ���ȵ�����ʵ��ʱ��������ȥ��Ӧ������ϩ���Ҵ��ӷ����Ҵ�����ϩ����ʹ���������ɫ��������ͼ2װ�ý���ʵ���Ŀ������֤���ɵ���������ϩ������֤��������NaOH������ȥ��Ӧ�IJ����ͼ���ұ��Թ��е������Ǹ��������Һ���Ϻ�ɫ��ȥ��ˮ�������dz�ȥ�����л��е������Ҵ������ʣ�
���Դ��ǣ���֤���ɵ���������ϩ������֤��������NaOH������ȥ��Ӧ�IJ�������������Һ���Ϻ�ɫ��ȥ����ȥ�����л��е������Ҵ������ʣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ������С��36��A��B��C��D��E����Ԫ�أ�ԭ��������������A��D���γ�����Һ̬��������ң�ԭ�Ӹ����ȷֱ�Ϊ2��1��1��1��B���γɻ�������������Ԫ�أ�Cԭ�ӻ�̬ʱ2pԭ�ӹ������3��δ�ɶԵĵ��ӣ�E��̬ԭ�ӵĵ�һ�ܲ�������ܲ����ĵ�������ͬ���ڶ��ܲ�������ܲ����ĵ�������ͬ��
��1��B2A2���л��ϳɹ�ҵ��һ��ԭ�ϣ� ��i����B2A2ͨ��[Cu��NH3��2]Cl��Һ����Cu2C2����ɫ������[Cu��NH3��2]Cl�д��ڵĻ�ѧ���������� �� Cu+��̬��������Ų�ʽΪ ��
��ii��B2A2��ABC��Ӧ�ɵñ�ϩ�棨H2C=CH��C��N����ABC���ӵĹ����� �� ��ϩ�������̼ԭ�ӹ���ӻ�������
��2����ҵ����EB2��A2D��Ӧ����B2A2 �� ��i��EB2�е�B22����D22+��Ϊ�ȵ����壬D22+�ĵ���ʽ�ɱ�ʾΪ��1mol D22+�к��еĦм���ĿΪ ��
��ii����ҵ��B2A2��ԭ�ϣ�EB2��A2D���Լ����B2A2���ķе�Ӹߵ���������˳��Ϊ���û�ѧʽ��ʾ����������Ϊ ��
��iii��EB2����ľ����ṹ��NaCl��������ƣ���ͼ��ʾ������EB2�����к��е���������B22���Ĵ��ڣ�ʹ������һ�����������������ı߳��ֱ�Ϊ0.387nm��0.387nm��0.637nm��EB2�����У������ӵ���λ��Ϊ �� �������������������֮��ľ���Ϊnm������3λ��Ч���֣���EB2���ܶ�g/cm3����ʽ���ɣ���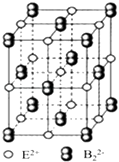
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A. �ܵ����H+�Ļ����ﶼ����
B. ����������������ɢϵ�ı����������ܲ��������ЧӦ
C. ��ˮ������ǵ����
D. ǿ�������Һ�ĵ�������һ��ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���мס�������װ��������˵���������
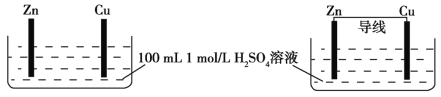
�� ��
A���ס���װ���У�Zn����������С
B���ס���װ���У�Cu�Ͼ������ݲ���
C����ѧ��Ӧ���ʣ���>��
D����װ����H+����Zn����װ����H+����Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ��2Ag+(aq) + Cu(s)Cu2+(aq) + 2Ag(s)��Ƶ�ԭ�����ͼ��ʾ��
��ش��������⣺
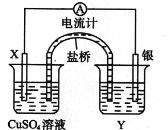
��1���缫X�IJ�����____________________���������ҺY��____________��
��2�����缫Ϊ��ص�___________���������ĵ缫��ӦΪ_____________________��X�缫�Ϸ����ĵ缫��ӦΪ_____________________��
��3�����·�еĵ����Ǵ�___________�缫����___________�缫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ֻ���¶��йص���
A.����ĵ����B.�����Ƶ�ˮ��̶�
C.ˮ�����ӻ�D.�������ܽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϻ�������ij�Ͻ���ϣ���Ҫ��Fe��Cu��Co��Li�ȣ���֪Co��Fe��Ϊ�еȻ��ý������Ĺ���������ͼ�� 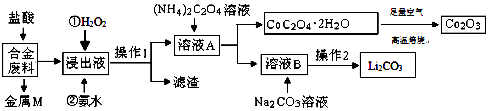 �ش��������⣺
�ش��������⣺
��1����NH4��2C2O4��C�Ļ��ϼ�Ϊ ��
��2���Ͻ���ϼ��������ȡ��������ܻ�Ϊ���ᣬԭ���� �� ����M ����Ҫ�ɷ���һ�ֽ������ʣ��ý���Ϊ ��
��3��������Һ�����Ⱥ����������Լ��漰��ˮ��H2O2��Һ��Ӧ�ȼ��� �� ���백ˮ������Ӧ�����ӷ���ʽΪ ��
��4����ҺA�еĽ����������� �� ���루NH4��2C2O4��Һ��Ŀ���� ��
��5��������l���������� �� �����ܸ��±�������Co2O3 �� ʵ�����и��±���ʹ�õ�������������ĸ���� a�������� b�������� c���ձ� d������
��6����֪Li2CO3����ˮ���䱥����Һ��Ũ�����¶ȹ�ϵ�����������2���У�����Ũ��������ȹ��ˣ���Ŀ���� �� 90��ʱKsp��Li2CO3����ֵΪ ��
�¶�/�� | 10 | 30 | 60 | 90 |
Ũ��/mol/L | 0.21 | 0.17 | 0.14 | 0.10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ2HI��g��=H2��g��+I2��g���ġ�H=+11kJmol��1 �� 1mol H2��g����1mol I2��g�������л�ѧ������ʱ�ֱ���Ҫ����436kJ��151kJ����������1mol HI��g�������л�ѧ������ʱ�����յ�����ΪkJ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com