
| A. | KBr | B. | LiBr | C. | NaF | D. | MgBr2 |
分析 先假设10.3g全部是NaBr,根据化学方程式NaBr+AgNO3=AgBr↓+NaNO3计算出生成沉淀的质量为18.8g,而实际生成的沉淀质量大于18.8g,则说明杂质物质中溴元素的质量分数要大于NaBr中Br元素的质量分数.
解答 解:先假设10.3g全部是NaBr,设反应生成的沉淀为xg,
NaBr+AgNO3=AgBr↓+NaNO3
103 188
10.3g xg
则x=$\frac{10.3g×188}{103}$=18.8g,
而实际生成的沉淀质量为19g,大于18.8g,则说明杂质物质中溴元素的质量分数要大于NaBr中Br元素的质量分数,选项中LiBr、MgBr2符合,NaF与硝酸银不产生沉淀,KBr中溴元素的质量分数要小于NaBr;
故选BD.
点评 本题考查混合物的计算,题目难度中等,解答时注意先通过假设样品为纯净物计算反应所产生沉淀质量与实际沉淀质量对比,试题培养了学生的化学计算能力.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 三者的单质在常温下都不溶于浓硫酸和浓硝酸,是因发生了钝化现象 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 三者所对应的氢氧化物在水中不都存在溶解平衡 | |
| D. | 工业上制备这三种金属的方法依次为电解法、热还原法和热还原法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | HClO═H++ClO- | ||
| C. | NaHCO3=Na++H++CO32- | D. | Ba(OH)2═Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3和KOH | B. | Na2CO3和盐酸 | C. | Na[Al(OH)4]和盐酸 | D. | AlCl3和氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制Na2S溶液时,为了抑制S2-的水解,常加入少量氢氧化钠 | |
| B. | 明矾用于净水过程只发生物理变化 | |
| C. | 把纯水加热水的电离程度增大,但水仍然是中性的,pH=7 | |
| D. | 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
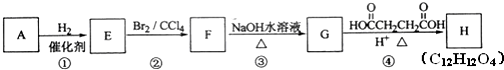
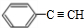 ,名称是苯乙炔;
,名称是苯乙炔;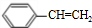 +Br2→
+Br2→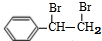 ;
;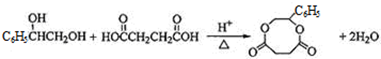 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
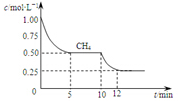 已知:①CO(g)+H2O(g)?H2(g)+CO2(g);△H=-41.2kJ/mol
已知:①CO(g)+H2O(g)?H2(g)+CO2(g);△H=-41.2kJ/mol| A. | △H3=+206kJ/mol | |
| B. | 反应③进行到10min时,改变的外界条件可能是升高温度 | |
| C. | 反应③进行过程中,0~5min这段时间共吸收的热量为103.05kJ | |
| D. | 当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com