
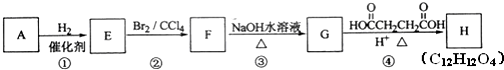
 ,名称是苯乙炔;
,名称是苯乙炔;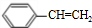 +Br2→
+Br2→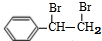 ;
;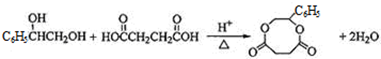 ;
; .
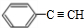
. 分析 A是芳香烃,令A的分子式为CxHy,1mol A完全燃烧消耗9.5molO2,则x+$\frac{y}{4}$=9.5,由转化关系可知A与氢气发生加成反应生成E,E与溴发生取代反应生成F,F发生取代反应生成G,G中含有2个醇-OH,G与发生酯化反应生成H,由H的分子式可知,A中含有2个8个C原子,则y=6,故A的分子式为C8H6,则A为 ,A与等物质的量的H2反应生成E为
,A与等物质的量的H2反应生成E为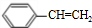 ,F为
,F为 ,G为
,G为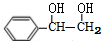 ,G与HOOCHCH2CH2COOH脱去2分子水生成环酯H为
,G与HOOCHCH2CH2COOH脱去2分子水生成环酯H为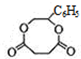 ,据此解答.
,据此解答.
解答 解:A是芳香烃,令A的分子式为CxHy,1mol A完全燃烧消耗9.5molO2,则x+$\frac{y}{4}$=9.5,由转化关系可知A与氢气发生加成反应生成E,E与溴发生取代反应生成F,F发生取代反应生成G,G中含有2个醇-OH,G与发生酯化反应生成H,由H的分子式可知,A中含有2个8个C原子,则y=6,故A的分子式为C8H6,则A为 ,A与等物质的量的H2反应生成E为
,A与等物质的量的H2反应生成E为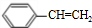 ,F为
,F为 ,G为
,G为 ,G与HOOCHCH2CH2COOH脱去2分子水生成环酯H为
,G与HOOCHCH2CH2COOH脱去2分子水生成环酯H为 .
.
(1)由上述分析可知,A的结构简式是 ,名称是苯乙炔,
,名称是苯乙炔,
故答案为: ;苯乙炔;
;苯乙炔;
(2)由E转化为F的化学方程式是: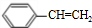 +Br2→
+Br2→ ,
,
故答案为: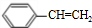 +Br2→
+Br2→ ;
;
(3)由G转化为H的化学方程式是: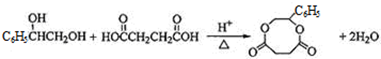 ,
,
故答案为: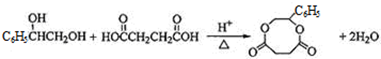 ;
;
(4)①的反应类型是加成反应,③的反应类型是取代反应,
故答案为:加成反应;取代反应;
(5)G( )的同分异构体有:①遇氯化铁溶液显紫色,说明含有酚羟基,②苯环上有三个取代基,③核磁共振氢谱显示苯环上有两种不同环境的氢原,应含有2个-OH、1个-CH2CH3,且3个取代基处于间位,或者3个取代基相邻,且-CH2CH3处于2个-OH之间,故符合条件的同分异构体共有2种,
)的同分异构体有:①遇氯化铁溶液显紫色,说明含有酚羟基,②苯环上有三个取代基,③核磁共振氢谱显示苯环上有两种不同环境的氢原,应含有2个-OH、1个-CH2CH3,且3个取代基处于间位,或者3个取代基相邻,且-CH2CH3处于2个-OH之间,故符合条件的同分异构体共有2种,
故答案为:2种;
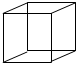
(6)烃B是E(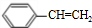 )的同分异构体,B分子中的每个碳原子都以单键分别跟其它3个碳原子相连,且B分子中只有一种碳-碳-碳键角,B的结构简式为
)的同分异构体,B分子中的每个碳原子都以单键分别跟其它3个碳原子相连,且B分子中只有一种碳-碳-碳键角,B的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物推断,综合分析确定A的结构简式,较好的考查学生分析推理能力,是对有机化合物知识的综合考查,需要学生熟练掌握官能团的性质与转化,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | M+N=P+Q | B. | M+2N=2P+Q | C. | 2M+N=2P+Q | D. | 2M+N=P+2Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8KJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+285.8KJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6KJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | KBr | B. | LiBr | C. | NaF | D. | MgBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
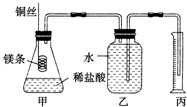 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com