
| A、常温下,pH=7的NH4Cl与氨水的混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) |
| B、0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C、pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| D、常温下,pH=2的CH3COOH与pH=12的NaOH等体积混合:c (CH3COO-)+c(H+)>c(Na+)+c(OH-) |
| 1 |
| 10 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、H2S?2H++S2- |
| B、NaHCO3═Na++H++CO32- |
| C、K2SO4═2K++SO42- |
| D、NH3?H2O═NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质编号 | 物质转化关系 | a | b | c | d |
| ① | 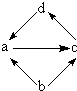 | FeCl2 | Fe | FeCl3 | CuCl2 |
| ② | Na2O | Na | Na2O2 | Mg(OH)2 | |
| ③ | NO | N2 | NO2 | NaCl | |
| ④ | Al2O3 | Al | Na[Al(OH)4] | Al(OH)3 |
| A、①②③ | B、①③④ |
| C、①④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若a1=a2,且混合溶液的pH<7,则b1>b2 |
| B、若混合溶液的pH<7,则a1b1=a2b2 |
| C、若混合溶液的pH=7,则混合溶液中c(CH3COO-)=c(Na+) |
| D、若a1=a2,b1=b2,则混合溶液中c(CH3COO-)<c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 | ||
| A | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH
| ||
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中,在滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液.再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红 下层溶液紫色红 实验现象2: 上层溶液变红 | 氧化性:Br2>Fe3+>I2 | ||
| C | 淀粉在稀硫酸的作用下水解后,滴加NaOH溶液至碱性,再加入新制Cu(OH)2后加热 | 有砖红色沉淀生成 | 淀粉已经完全水解 | ||
| D | BaSO4固体加入饱和Na2CO3溶液中,过滤,箱滤渣中加入盐酸 | 有气体生成 | Ksp(BaCO3)<Ksp(BaSO4) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、水的离子积常数关系为:C>A |
| B、升高温度可实现由C点到A点 |
| C、T1时,pH=4的硫酸与pH=l0的氢氧化钠溶液等体积混合,所得溶液的pH=7 |
| D、图中矩形OMAP的面积表示T2时水的离子积的值 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com