
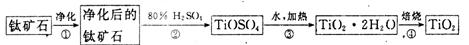
 TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。 394 kJ/mol。
394 kJ/mol。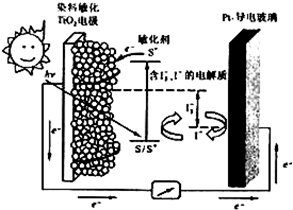
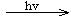 TiO2/S*(激发态)
TiO2/S*(激发态) TiO2/S+ + e-
TiO2/S+ + e- 3I-
3I- 2TiO2/S + I3-
2TiO2/S + I3-| A.电池工作时,I-离子在镀铂导电玻璃电极上放电 |
| B.电池工作时,是将太阳能转化为电能 |
| C.电池的电解质溶液中I-和I3- 浓度不会减少 |
| D.电池中镀铂导电玻璃为正极 |
 H2TiO3↓+ H2SO4是一个吸热反应,加热促进TiOSO4水解趋于完全。(2分) (2)该反应的△H>0,△S<0,反应难以自发进行(2分);-243kJ/mol(2分);TiO2(s)+2Cl2(g)
H2TiO3↓+ H2SO4是一个吸热反应,加热促进TiOSO4水解趋于完全。(2分) (2)该反应的△H>0,△S<0,反应难以自发进行(2分);-243kJ/mol(2分);TiO2(s)+2Cl2(g) TiCl4(1)+O2(g) 碳与氧气反应,减小了产物O2(g)的浓度,平衡向正反应方向移动,使反应能顺利进行(1分) (3)BCD(3分)
TiCl4(1)+O2(g) 碳与氧气反应,减小了产物O2(g)的浓度,平衡向正反应方向移动,使反应能顺利进行(1分) (3)BCD(3分) H2TiO3↓+ H2SO4是一个吸热反应,因此加热的目的是促进TiOSO4水解趋于完全。(2)根据反应的方程式可知,该反应是吸热的、体积减小的可逆反应,即该反应的△H>0,△S<0, 所以反应难以自发进行;根据反应①TiO2(s)+2Cl2(g)
H2TiO3↓+ H2SO4是一个吸热反应,因此加热的目的是促进TiOSO4水解趋于完全。(2)根据反应的方程式可知,该反应是吸热的、体积减小的可逆反应,即该反应的△H>0,△S<0, 所以反应难以自发进行;根据反应①TiO2(s)+2Cl2(g) TiCl4(1)+O2(g)和反应②C(s)+O2(g)=CO2(g)并结合盖斯定律可,①+②即得到TiO2(s)+C(s)+2Cl2(g)=TiCl4(1)+CO2(g) ,所以该反应的反应热△H=+151 kJ/mol-394 kJ/mol=-243kJ/mol。由于碳与氧气反应,减小了产物O2(g)的浓度,使可逆反应TiO2(s)+2Cl2(g)
TiCl4(1)+O2(g)和反应②C(s)+O2(g)=CO2(g)并结合盖斯定律可,①+②即得到TiO2(s)+C(s)+2Cl2(g)=TiCl4(1)+CO2(g) ,所以该反应的反应热△H=+151 kJ/mol-394 kJ/mol=-243kJ/mol。由于碳与氧气反应,减小了产物O2(g)的浓度,使可逆反应TiO2(s)+2Cl2(g) TiCl4(1)+O2(g)向正反应方向移动,所以能使反应能顺利进行。
TiCl4(1)+O2(g)向正反应方向移动,所以能使反应能顺利进行。 3I-,所以电池的电解质溶液中I-和I3- 浓度不会减少,C正确;
3I-,所以电池的电解质溶液中I-和I3- 浓度不会减少,C正确;

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
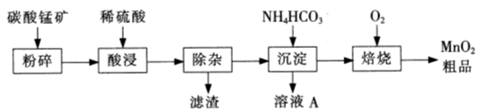
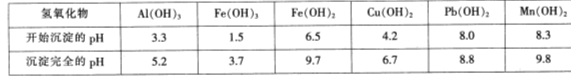
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 溶液中一定含有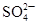 |
| B | 向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色气体 | 溶液中一定含有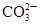 |
| C | 用酸度计测定SO2和CO2饱和溶液的pH,前者pH小 | H2SO3酸性强于H2CO3 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| | 苯 | 溴 | 溴苯 |
| 密度/g·cm-3 | 0. 88 | 3. 10 | 1. 50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
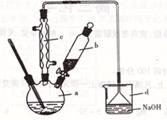
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 现象与结论 |
| 步骤1 :向试管中加入少量固体产物,再加入足量_________________,充分振荡 | 若溶液颜色明显改变,且有_______生成,则证明有铁单质存在 |
| 步骤2: 将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体与试管中, 滴加___________________________________ _______________________________________ | __________________________________ ___________________________________ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2SO4 H2SO4 AlCl3 BaCl2 | B.HCl NaOH K2SO4 NaHCO3 |
| C.AlCl3 KHCO3 NaCl Na2SO4 | D.NaOH FeCl3 MgCl2 K2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com