
| A. | 若单位时间内生成的B和D的物质的量之比为3:1,则体系处于平衡状态 | |
| B. | C的平衡浓度为1mol/L | |
| C. | 5min内B的平均消耗速率为0.3mol/(L•min) | |
| D. | 平衡后,增大压强,平衡向正反应方向移动 |
分析 A.生成B为逆反应速率,生成D为正反应速率,当二者的比值等于计量数之比即是平衡状态;
B.依据三段式计算方法列式计算分析判断;
C.根据B的反应的量求出浓度变化,再根据速率公式计算;
D.反应前后气体的体积不变,增大压强平衡不移动.
解答 解:A.生成B为逆反应速率,生成D为正反应速率,当二者的比值等于计量数之比即是平衡状态,故A正确;
B.起始时充入3molA和2.5molB混合气体;经过5min生成0.5molD
2A(s)+3B(g)?2C(g)+D(g),
起始量(mol) 3 2.5 0 0
变化量(mol) 1 1.5 1 0.5
平衡时(mol) 2 1 1 0.5
平衡时c(C)=$\frac{1mol}{2L}$=0.5mol/L,故B错误;
C.参加反应的B为1.5mol,所以v(B)=$\frac{\frac{1.5mol}{2L}}{5min}$=0.15mol/(L•min),故C错误;
D、反应前后气体的体积不变,增大压强平衡不移动,故D错误;
故选A.
点评 本题考查化学平衡的计算,题目难度不大,涉及化学速率计算的应用、平衡状态的判断、影响平衡的因素等知识,注意掌握化学平衡及其影响,明确化学反应速率的概念及表达式,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| x | 温度 | 压强 | SO2的浓度 | 加入催化剂 |
| y | 容器内气体密度 | CO2的体积分数 | 平衡常数 | CO的转化率 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 很多城市对废旧电池进行回收处理 | |
| B. | 有些国家对聚乙烯等塑料垃圾进行了深埋或者倾倒入大海处理 | |
| C. | 不少地区正在使用沼气,太阳能,风能等能源替代传统的煤炭 | |
| D. | 许多地方政府出台相关法规来保护生物物种多样性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
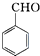 +KOH→
+KOH→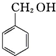 +
+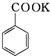
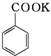 +HCl→
+HCl→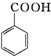 +KCl
+KCl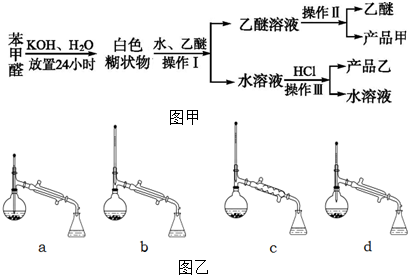
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:P4(白磷,s)═4P(红磷,s)△H<0,则白磷比红磷稳定 | |
| B. | 由CH3CH2CH2CH3(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2658 kJ•mol-1可知正丁烷的标准燃烧热为2658 kJ•mol-1 | |
| C. | OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ•mol-1,故1 mol醋酸与1 mol NaOH完全反应,放出的热量为57.3 kJ•mol-1 | |
| D. | 已知:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1 N2(g)+O2(g)═2NO(g)△H=+180 kJ•mol-1 则2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-746 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应都伴随着热量的变化 | |
| B. | 个别化学反应与能量变化无关 | |
| C. | 某些吸热反应在不加热条件下也能发生 | |
| D. | 放热反应的发生无需任何条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
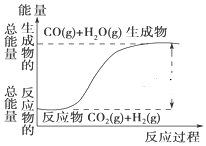
| A. | 其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=41kJ•mol-1 | |
| B. | 该反应为吸热反应 | |
| C. | 该反应为放热反应 | |
| D. | 当H2O为液态时,其反应热值大于41kJ•mol-1. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知CaO+H2O═Ca(OH)2放出大量的热,故可把该反应设计成原电池 | |
| B. | 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁做负极、铜做正极 | |
| C. | 理论上说,任何能自发进行的氧化还原反应都可设计成原电池 | |
| D. | 某原电池反应为Cu+2AgNO3═Cu(NO3)2+2Ag,装置中的盐桥内可以是含琼脂的KCl饱和溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com