
����Ŀ�������Ԫ�����ڱ���һ���֣�����Ԫ���ڱ��е�λ�ã����û�ѧ����ش���������:

(1)��ЩԪ���У���ѧ���������ԭ�ӵ�ԭ�ӽṹʾ��ͼΪ______����̬�⻯���У����ȶ�����______������������Ӧˮ�����У�������ǿ����_______��
(2)�ٺ͢�����Ԫ�ص�ԭ�Ӱ�1:1��ɵij���������ĵ���ʽΪ______��
(3)�ڡ��۵ĵ����и�������ٵĵ��ʷ�Ӧ����________(�û�ѧʽ��ʾ)��
(4)�ܡ��ߡ��ࡢ��ļ����Ӱ뾶�ɴ�С��˳��Ϊ_____(�����ӷ��ź͡�>����ʾ)��
(5)�͢������������Ӧˮ����֮�䷢����Ӧ�����ӷ���ʽ____________��
(6)�ݢ�����Ԫ�صĵ��ʷе��ɸߵ��͵�˳����_____(�û�ѧʽ�͡�>����ʾ)��
���𰸡� 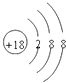 HF HClO4
HF HClO4 ![]() N2 r��Cl������r��O2������r��Mg2+���� r��Al3+�� Al��OH��3+OH��=AlO2��+2H2O {����Al(OH)3+OH��=[Al(OH)4]��} Br2 �� Cl2 �� F2
N2 r��Cl������r��O2������r��Mg2+���� r��Al3+�� Al��OH��3+OH��=AlO2��+2H2O {����Al(OH)3+OH��=[Al(OH)4]��} Br2 �� Cl2 �� F2
�����������ݸ�Ԫ�������ڱ��е�λ�ã��١��ڡ��ۡ��ܡ��ݡ��ޡ��ߡ��ࡢ�ᡢ�⡢���δ���H��C��N��O��F��Na��Mg��Al��Cl��Ar��BrԪ��������Ԫ�������ɺ���ػ�ѧ��������
���ݸ�Ԫ�������ڱ��е�λ�ã��١��ڡ��ۡ��ܡ��ݡ��ޡ��ߡ��ࡢ�ᡢ�⡢���δ���H��C��N��O��F��Na��Mg��Al��Cl��Ar��BrԪ����
��1����ЩԪ���У���ѧ��������õ�ԭ����Ar��Ar�ĺ˵����Ϊ18��Ar��ԭ�ӽṹʾ��ͼΪ![]() ��ͬ���ڴ�����Ԫ�صķǽ���������ǿ����̬�⻯����ȶ�������ǿ������������Ӧˮ������������ǿ��ͬ������ϵ���Ԫ�صķǽ�������������̬�⻯����ȶ�������������������Ӧˮ���������������ǽ�������ǿ��Ԫ�ش���Ԫ�����ڱ������Ͻǣ���̬�⻯�������ȶ�����HF������Fû�����ۣ�����������Ӧˮ������������ǿ����HClO4��
��ͬ���ڴ�����Ԫ�صķǽ���������ǿ����̬�⻯����ȶ�������ǿ������������Ӧˮ������������ǿ��ͬ������ϵ���Ԫ�صķǽ�������������̬�⻯����ȶ�������������������Ӧˮ���������������ǽ�������ǿ��Ԫ�ش���Ԫ�����ڱ������Ͻǣ���̬�⻯�������ȶ�����HF������Fû�����ۣ�����������Ӧˮ������������ǿ����HClO4��
��2���١����ֱ����H��OԪ�أ�����Ԫ�ص�ԭ�Ӱ�1:1��ɵij���������ΪH2O2��H2O2�ĵ���ʽΪ![]() ��
��
��3���١��ڡ����ֱ����H��C��NԪ�أ��ǽ�����C![]() N���ڡ����ĵ����и�����H2��Ӧ����N2��
N���ڡ����ĵ����и�����H2��Ӧ����N2��
��4���ܡ��ߡ��ࡢ���ֱ����O��Mg��Al��ClԪ�������ǵļ���������ΪO2-��Mg2+��Al3+��Cl-�����ݡ���ྶ�����С�����ܡ��ߡ��ࡢ���ļ����Ӱ뾶�ɴ�С��˳��Ϊr��Cl-��![]() r��O2-��
r��O2-��![]() r��Mg2+��
r��Mg2+��![]() r��Al3+����
r��Al3+����
��5���ޡ����ֱ����Na��AlԪ�أ�Na��Al������������Ӧˮ����ֱ�ΪNaOH��Al��OH��3��NaOH��Al��OH��3��Ӧ�Ļ�ѧ����ʽΪNaOH+Al��OH��3=NaAlO2+2H2O{��NaOH+Al��OH��3=Na[Al��OH��4]}�����ӷ���ʽΪAl��OH��3+OH-=AlO2-+2H2O{��Al��OH��3+OH-=[Al��OH��4]-}��
��6���ݡ��ᡢ�ֱ����F��Cl��Br�����ǵĵ�������ΪF2��Cl2��Br2��F2��Cl2��Br2����Է���������������F2��Cl2��Br2�ķ��Ӽ�������������ǿ���е��ɸߵ��͵�˳��ΪBr2![]() Cl2
Cl2![]() F2��
F2��


 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��ס������ձ�ʢ��ͬŨ��ͬ�����ϡ���Ὣ��пƬ�ʹ�ͭƬ�ֱ�ͼʾ��ʽ�������У������й�ʵ���������۵�������ȷ����
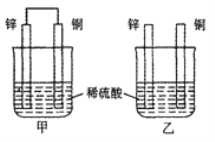
A. ���ձ���ͭƬ����������ݲ���
B. ����ͭƬ������������ͭƬ�Ǹ���
C. �ױ���Һ��c(H+)��С���ұ���Һ��c(H+)���
D. �������ݵ����ʼױ��ҿ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������Ԥ����ȷ����( )
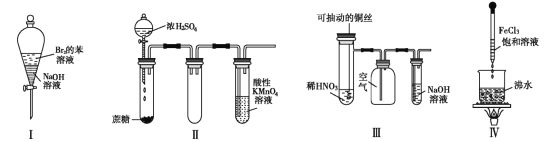
A. ʵ������ã��ϲ���Һ��ɫ���ֲ���
B. ʵ��� ������ KMnO4 ��Һ�г������ݣ�����ɫ����ȥ
C. ʵ�����ϡ HNO3 Ƭ�̣���Һ�������ݲ��������ƿ��ʼ�ձ�����ɫ
D. ʵ��������� FeCl3 ���γɴ���Ľ��壬�÷�ɢϵ����������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����¯���������з�������Ҫ��ӦΪ ![]() Fe2O3��s��+CO��g��
Fe2O3��s��+CO��g�� ![]() Fe��s��+CO2��g����H��0�������������ӦCO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�ǣ�������
Fe��s��+CO2��g����H��0�������������ӦCO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�ǣ�������
A.��߷�Ӧ�¶�
B.�Ƴ�����CO2
C.������ʵĴ���
D.��С�������ݻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ�����о�NO2��NO��CO��NO2- �ȴ�����Ⱦ���ˮ��Ⱦ��Ĵ����Խ��������й�������Ҫ���塣
��1����֪����NO2 + CO ![]() CO2 + NO �÷�Ӧ��ƽ�ⳣ��ΪK1����ͬ��
CO2 + NO �÷�Ӧ��ƽ�ⳣ��ΪK1����ͬ��
ÿ1mol�������ʷֽ�Ϊ��̬��̬ԭ�����������ֱ�Ϊ
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
��N2(g)+O2(g) ![]() 2NO(g) ��H��+179.5 kJ/mol K2
2NO(g) ��H��+179.5 kJ/mol K2
��2NO(g) +O2(g)![]() 2NO2(g) ��H��-112.3 kJ/mol K3
2NO2(g) ��H��-112.3 kJ/mol K3
��д��NO��CO��Ӧ��������Ⱦ��������Ȼ�ѧ����ʽ____________________________�Լ����Ȼ�ѧ����ʽ��ƽ�ⳣ��K=____________����K1��K2��K3��ʾ��
��2����Ⱦ������NO2��CO��һ�������µķ�ӦΪ��2NO2+4CO![]() 4CO2+N2��ij�¶��£���1L�ܱ������г���0.1mol NO2��0.2mol CO����ʱ������ѹǿΪ1������ѹ��5��ʱ��Ӧ�ﵽƽ��ʱ��������ѹǿ��Ϊԭ����
4CO2+N2��ij�¶��£���1L�ܱ������г���0.1mol NO2��0.2mol CO����ʱ������ѹǿΪ1������ѹ��5��ʱ��Ӧ�ﵽƽ��ʱ��������ѹǿ��Ϊԭ����![]() ����Ӧ��ʼ��ƽ��ʱCO��ƽ����Ӧ����v(CO)=________��
����Ӧ��ʼ��ƽ��ʱCO��ƽ����Ӧ����v(CO)=________��
�����¶��£�ijʱ�̲��NO2��CO��CO2��N2��Ũ�ȷֱ�Ϊamol/L��0.4mol/L��0.1mol/L��1mol/L��Ҫʹ��Ӧ���淴Ӧ������У�a��ȡֵ��Χ________________��
��3���绯ѧ����NO2-��ԭ������ͼ��
����Դ�ĸ�����____________����A��B��������ӦʽΪ________________��
������������ת����6mol���ӣ���Ĥ������Һ�������仯��![]() Ϊ_____g��
Ϊ_____g��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���M��N��Q��ת����ϵ����ͼ��ʾ������˵����ȷ����
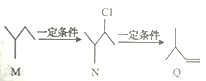
A. M ��������2һ��һ����
B. N��NaOH ��ˮ��Һ�з�����ȥ��Ӧ����Q
C. Q���������е�̼ԭ��һ������
D. N ��ͬ���칹����7 ��(�����������칹������������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����C2H2��C6H6��C2H4O��ɵĻ�����У���֪̼Ԫ�ص���������Ϊ84%������������Ԫ�ص����������ǣ� ��
A. 9% B. 8% C. 7% D. 12%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������й㷺����;����ȡ������;���ж��֡����������գ�
��1����ҵ���õ�ⱥ��ʳ��ˮ��ȡ�����������ڵ��ص�______���������������������Ʒ�Ӧ�õ��������������ƣ�������Ӧ�Ļ�ѧ����ʽΪ________�������������Һ�м�������ϡ���ᣬ������ǿ����Ч����������Ϊ������_____�����������ƣ���
��2��ʵ������ȡ�����Ļ�ѧ����ʽΪMnO2��4HCl(Ũ) ![]() MnCl2��Cl2����2H2O���÷�Ӧ�У�������______������������������ԭ�����������Ӧ������ת����2 mol���ӣ����ڱ�״���¿��Եõ�_______L������
MnCl2��Cl2����2H2O���÷�Ӧ�У�������______������������������ԭ�����������Ӧ������ת����2 mol���ӣ����ڱ�״���¿��Եõ�_______L������
��3��ʵ���ҳ����ű���ʳ��ˮ�ķ����ռ�����������ƽ���ƶ�ԭ�������ñ���ʳ��ˮ������ˮ��ԭ��___________
��4���л������л����÷�Ӧ4HCl(g)��O2(g)![]() 2Cl2(g)��2H2O(g)��Q��Q��0����������������5 L���ܱ������м���0.5 mol HCl��0.2 mol O2����һ�������·�����Ӧ��Cl2�����ʵ�����ʱ��t�Ĺ�ϵ��ͼ��OA����ʾ��0��8 minʱCl2��ƽ����Ӧ����Ϊ_________________��t0ʱ�̸ı�ijһ������Cl2�����ʵ����仯������ͼ��AB����ʾ����t0ʱ�ı������һ����__________��
2Cl2(g)��2H2O(g)��Q��Q��0����������������5 L���ܱ������м���0.5 mol HCl��0.2 mol O2����һ�������·�����Ӧ��Cl2�����ʵ�����ʱ��t�Ĺ�ϵ��ͼ��OA����ʾ��0��8 minʱCl2��ƽ����Ӧ����Ϊ_________________��t0ʱ�̸ı�ijһ������Cl2�����ʵ����仯������ͼ��AB����ʾ����t0ʱ�ı������һ����__________��
a�������¶� b������ѹǿ c������HCl

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵı仯�����У���˷����Ӽ�����������
A.ˮ�ĵ��B.��ʯ�ҵ��ۻ�C.�ƾ�������D.�Ȼ��Ƶĵ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com