
【题目】食用油中含有的主要成分属于
A. 糖类B. 维生素C. 无机盐D. 油脂
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】盐在化学工业中有重要的应用,请回答下列问题
(1)用离子方程式表示FeCl3可作净水剂的原因:___________________ 。
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为_____ , 向Na2S溶液中加入AlCl3溶液时,产生白色沉淀和有臭鸡蛋味的气体,其离子方程式为:_________________。
(3)c(NH4+)相等的下列溶液① NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4
⑤NH3 H2O,溶液的物质的量浓度由小到大的顺序是__________ (用序号表示)
(4)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列正确的是 _______
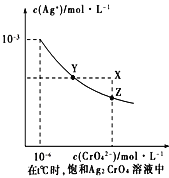
A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点
C.在t ℃时,以0.01mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
(5)已知某温度时:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。在该温度下向Fe3+、Cu2+均为0.01molL-1的溶液中逐滴加入NaOH溶液,要Fe3+完全沉淀,而Cu2+不产生沉淀,溶液中PH应控制的范围是_______。(当离子浓度小于1×10-5mol/L时,认为完全沉淀)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向10L容积不变的密闭容器中加入1.0molNH2COONH4,发生反应NH2COONH4(s)![]() CO2(g)+2NH3(g) ΔH>0。5min达到平衡时,测得容器中NH2COONH4(s)的物质的量为0.2mol。下列说法正确的是
CO2(g)+2NH3(g) ΔH>0。5min达到平衡时,测得容器中NH2COONH4(s)的物质的量为0.2mol。下列说法正确的是
A. 0~5min内,v(CO2)=0.16mol·L-1·min-1
B. 氨气体积分数不变时,该反应一定达到平衡状态
C. 平衡后,缩小容器容积,重新建立平衡时,c(CO2)增大
D. 其他条件不变,若将原容器改为绝热容器,则达到平衡时,NH2COONH4的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分Fe2+在风化过程中会转化为+3价。

已知:TiO(OH)2(即H2TiO3)为两性氢氧化物
(1)步骤②中,发生反应的主要离子方程式为______________________。
(2)步骤③中,实现混合物的分离是利用物质的____________(填字母序号)。
A.熔沸点差异 B.溶解性差异 C.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是____________(填操作名称)。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:________________________________。
(5)上述工艺流程中可以循环利用的物质是____________。
(6)在酸性环境中,利用电化学原理可生成的羟基自由基(·OH) 其反应为Fe2++H2O2=Fe3++OH-+·OH-,成的羟基自由基对有机物有极强的氧化能力,可用于水体里有机污染物降解的高级氧化技术。电解原理如图:

①写出阳极所发生反应的电极反应式__________________________。
②电解过程中,假设电极上每1molFe3+转变为Fe2+ 的同时也 消耗1molO2,则 每消耗1molO2电解液中可以产生______mol ·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是

A.放电时,Li+透过固体电解质向Cu极移动
B.放电时,负极的电极反应式为Cu2O+H2O+2e-═2Cu+2OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,室温下向盛有3.0mL NO的试管中缓缓通入1.5mL O2(所有气体体积均在标准状况下测定)。

试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①____________________________________________________________________;
②____________________________________________________________________;
③____________________________________________________________________。
(2)最终试管中剩余的气体是________,体积为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种溶液中含有一种卤素离子(Cl-、Br-、I-),向甲中加入淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化,则甲、乙、丙中依次含有( )
A. Br-、I-、Cl-B. Br-、Cl-、I-C. I-、Br-、Cl-D. Cl-、I-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同温度和压强下,等质量的SO2和O2。二者体积比为________,分子个数比为________,密度比为________。
(2)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是________,混合气体的平均相对分子质量是________,密度是________g·L1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com