
| A | B | C | D | |
| Na2O2(mol) | 0.2 | 0.4 | 0.6 | 0.7 |
| 沉淀(mol) | 0 | 0.2 | 0.3 | 0.1 |
| 气体(mol) | 0.3 | 0.4 | 0.5 | 0.6 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、它们的密度之比为 1:1 |
| B、它们的分子数目之比是 1:1 |
| C、它们的体积之比是 1:1 |
| D、它们的氧原子数目之比为 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除②④外 | B、除②③外 |
| C、除③⑥外 | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
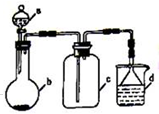 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中的物质 | b中的物质 | C中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 稀硝酸 | Cu | NO2 | H2O |
| C | 稀硝酸 | FeS | H2S | NaOH溶液 |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀产生,说明Ksp(BaSO4)大于Ksp(BaCO3) |
| B、H2C2O4、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性 |
| C、SiO2具有导电性,可用于制造半导体材料 |
| D、油脂的种类很多,但它们水解后一定都有一种产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

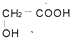 ④
④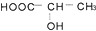 ⑤
⑤ ⑥
⑥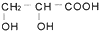
查看答案和解析>>
科目:高中化学 来源: 题型:
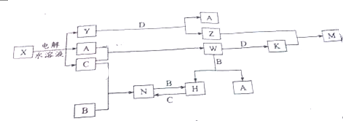
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com