
| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1 mol•L-1 NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{3}{2}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O42-)+c(OH-)=c(Na+)+c(H+) |
分析 A.0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合,溶质为醋酸和氯化钠,醋酸为弱酸部分电离;
B.0.1 mol•L-1 NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7),溶液显碱性说明一水合氨电离程度大于铵根离子的水解程度;
C.0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合溶液中存在物料守恒,2n(Na)=3n(C),钠离子总物质的量等于碳元素所有存在形式总和
D.0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合得到等浓度NaCl和NaHC2O4,溶液中存在电荷守恒.
解答 解:A.0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合,溶质为醋酸和氯化钠,醋酸为弱酸部分电离c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-),故A正确;
B.0.1 mol•L-1 NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7),溶液显碱性说明一水合氨电离程度大于铵根离子的水解程度,c(NH3•H2O)<c(NH4+),故B错误:
C.0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合溶液中存在物料守恒,2n(Na)=3n(C),钠离子总物质的量等于碳元素所有存在形式总和,2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],则C错误;
D.0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合得到等浓度NaCl和NaHC2O4,溶液中存在电荷守恒,2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),故D错误;
故选A.
点评 本题考查了化学反应后溶液酸碱性比较、电解质溶液中离子浓度大小比较、溶液中电荷守恒和物料守恒的计算应用等,掌握基础是解题关键,题目难度中等.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:多选题
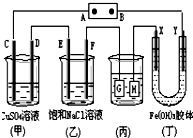 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| C. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HClO4>H2SO4>H3PO4 | B. | 离子半径:Na+>Mg2+>Al3+>F- | ||
| C. | 热稳定性:HCl>H2S>PH3>SiH4 | D. | 熔点:SiO2>NaCl>I2>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱法的基本原理:Na++NH3+H2O+CO2=NaHCO3↓+NH4+ | |
| B. | 向KAl(SO4)2溶液中加入Ba(OH)2溶液至中性:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O | |
| D. | 向漂白粉溶液中通入少量的SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
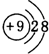 ,元素d与元素g形成的原子个数比为1:1的化合物的电子式为
,元素d与元素g形成的原子个数比为1:1的化合物的电子式为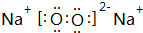 ;(用元素符号填空)
;(用元素符号填空)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
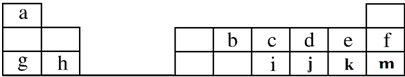
 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F 是前四周期原子电子轨道表示式中单电子数最多的元素 |
| G在周期表的第十一列 |
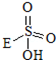 →
→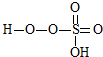 +HE (请写出横线上物质的结构式)
+HE (请写出横线上物质的结构式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Na→Na2O2→Na2CO3→NaCl | ||
| C. | Fe→FeCl3→Fe(OH)3→Fe2O3 | D. | Al→Al2O3→AlCl3→Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
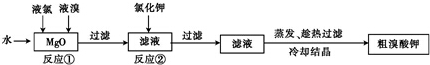
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com