
| A. | 侯氏制碱法的基本原理:Na++NH3+H2O+CO2=NaHCO3↓+NH4+ | |
| B. | 向KAl(SO4)2溶液中加入Ba(OH)2溶液至中性:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O | |
| D. | 向漂白粉溶液中通入少量的SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
分析 A.侯氏制碱法的基本原理:二氧化碳、氨气、氯化钠反应生成碳酸氢钠和氯化铵;
B.向KAl(SO4)2溶液中加入Ba(OH)2溶液至中性,二者反应生成氢氧化铝、硫酸钡、硫酸钾;
C.过氧化氢具有氧化性,能够氧化二价铁子生成三价铁离子;
D.次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子.
解答 解:A.侯氏制碱法的基本原理:二氧化碳、氨气、氯化钠反应生成碳酸氢钠和氯化铵,离子方程式:Na++NH3+H2O+CO2=NaHCO3↓+NH4+,故A正确;
B.向KAl(SO4)2溶液中加入Ba(OH)2溶液至中性,离子方程式:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓,故B正确;
C.硫酸亚铁溶液中滴加酸化的双氧水,离子方程式:2Fe2++2H++H2O2=2Fe3++2H2O,故C正确;
D.向次氯酸钙溶液中通入少量SO2的离子反应为Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+,故D错误;
故选:D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应及分析与应用能力的考查,题目难度不大.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:| 滴定次数 | 待测盐酸的体积(mL) | 标准NaOH溶液体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
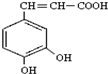 )也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效.
)也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效. .写出咖啡酸与NaHCO3溶液反应的方程式::
.写出咖啡酸与NaHCO3溶液反应的方程式::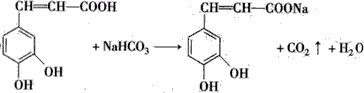 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{△}^{浓硫酸}$CH3COOCH(CH3)2+H2O.
$→_{△}^{浓硫酸}$CH3COOCH(CH3)2+H2O.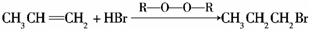 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ③⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 NaOH NaCl MgO | B. | H2SO4 AlCl3 CaCO3 Na2O | ||
| C. | NO2 Ba(OH)2 CaO H2O2 | D. | HBr KOH BaSO4 CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1 mol•L-1 NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{3}{2}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O42-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 计算机芯片的组成元素位于第14纵行 | |
| B. | 第10纵行元素全部是金属元素 | |
| C. | 第3纵行元素的种类最多 | |
| D. | 只有第2纵行元素的原子最外层有2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
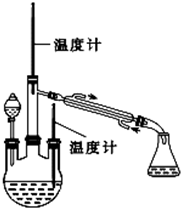 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com